Холецистит – это воспаление желчного пузыря. Сопровождается нарушением работы желчевыводящей системы и выраженным застоем желчи.
Ветеринарная клиника Сотникова — Библиотека статей для ветеринарных специалистов студентов ветеринарных ВУЗов
Лечение дисфункции билиарного тракта в сети клиник АО Семейный доктор
Застой желчи в желчном пузыре или холестаз, развивается у собак в результате воздействия различных факторов, среди которых лидирующие места занимают патологии печеночных структур, самого желчного или воспалительные процессы поджелудочной железы.
Дисфункция билиарного тракта
Среди заболеваний билиарного тракта первое место принадлежит дискинетическим расстройствам.
Под дисфункциями желчевыводящих путей (ранее их называли дискинезиями) подразумеваются нарушения моторно-эвакуаторной функции желчного пузыря, протоков, а также нарушение тонуса сфинктера Одди. Эти изменения приводят к нарушению процесса образования и выделения желчи, а в дальнейшем – и к её застою. Дисфункции билиарного тракта – это функциональные расстройства длительностью более 3-х месяцев. Они могут носить периодический, кратковременный или затяжной характер, проявляясь в виде болей в правом подреберье.
Желчь выполняет важную роль в процессе пищеварения. Она нужна для “размыления“ жиров до состояния эмульсии. Затем она в кишечнике обрабатывается ферментами, расщепляется и всасывается. Желчь представляет собой водяной раствор, состоящий на 70% из солей желчных кислот (холевая и хенодиоксихолевая), на 22% – из фосфолипидов (лецитина), на 4% – из холестерина, на 3% – из белка и на 0,3% – из билирубина. При недостаточном количестве желчных кислот – лецитина и холестерина – появляется нерастворимый холестерин, и желчь становится литогенной. При застойных явлениях в билиарном тракте происходят изменения состава желчи, развивается воспалительный процесс и появляется осадок в желчи – билиарный сладж, что в дальнейшем может привести к образованию конкрементов.
Классификация дисфункциональных расстройства билиарного тракта
дисфункция желчного пузыря;
дисфункция сфинктера Одди.
гипофункция или гиперфункция желчного пузыря;
спазм или недостаточность сфинктера Одди.
Оставьте телефон –
и мы Вам перезвоним
Причины дисфункции билиарного тракта

Первичная дискинезия желчевыводящих путей может возникнуть у детей из-за: несогласованной работы симпатической и парасимпатической нервной системы: снижается тонус сфинктера Одди и желчного пузыря. Также различные стрессы, неправильный режим питания или погрешности в еде (употребления большого количества жирной пищи, переедание или нерегулярный прием пищи) приводят к тому, что нервно-мышечный аппарат желчного пузыря становится раздражённым и плохо сокращается.
Вторичная дискинезия желчевыводящих путей появляется из-за: хронических болезней пищеварительной системы, глистной инвазии; врождённых пороков развития желчевыводящих путей; эндокринных нарушений, воспалительных заболеваний пищеварительной системы.
Симптомы дисфункции билиарного тракта
Клинические проявления дисфункциональных расстройств билиарного тракта достаточно широки и могут носить неспецифический характер. Жалобы многосимптомны, как правило, связаны с психосоциальными факторами. Их можно условно разделить на три группы.
Для гипертонической формы дисфункции желчного пузыря характерны острые приступообразные, колющие, сжимающие кратковременные боли в правом подреберье или вокруг пупка, сопровождающиеся, как правило, тошнотой, отрыжкой или даже рвотой, но без подъема температуры.
Для гипотонической формы характерны ноющие, давящие, тупые боли, приобретающие постоянный характер и связанные с приемом пищи, физической нагрузкой или эмоциональным напряжением. Отмечается горечь во рту, тошнота.
Для спазма сфинктера Одди в сочетании со сниженным тонусом желчного пузыря характерны тупые, ноющие боли в животе. При недостаточности сфинктера Одди, характерны ранние боли после приема жирной пищи, они могут быть и острыми и ноющими, в сочетании с проявлениями диспепсии.
Наблюдаются тошнота, рвота, отрыжка, изжога, горечь во рту, чувство тяжести в эпигастрии, изменение характера и частоты стула. Все это связано с несвоевременным выделением желчи в двенадцатиперстную кишку и нарушением переваривания жиров, с дуоденогастральным и гастроэзофагальными рефлюксами.
Головная боль, чувство кома в горле, потливость, сонливость, быстрая утомляемость, кардиалгия, похолодание конечностей, изменение поведения, тревожность, истерия, снижение способности к обучению и работоспособности.
Методы диагностики дисфункции билиарного тракта
Обилие и многообразие симптомов дисфункциональных расстройств билиарного тракта вызывает затруднения в постановке диагноза, что требует дополнительного
обследования.
К скриниговым методам диагностики относятся: биохимические исследования сыворотки крови, УЗИ органов брюшной полости и ЭГДС.
Для уточнения диагноза используются УЗИ с определением функции желчного пузыря и сфинктера Одди, динамическая холесцинтиграфия, ЭРХПГ.
Чтобы точно продиагностировать заболевание, запишитесь на прием к специалистам сети «Семейный доктор».
Методы лечения дисфункции билиарного тракта
Лечение дисфункциональных расстройств билиарного тракта должно быть комплексным и направлено на нормализацию оттока жёлчи и секреции поджелудочной железы. Для этого необходимо нормализовать режим и характер питания. Пища является стимулятором сокращения желчного пузыря, поэтому питание должно быть дробным, до 5 раз в день, небольшими порциями, при этом прием пищи желательно проводить в одно и то же время. Рацион должен быть выстроен так, чтобы на первую половину дня приходилось 55-60% от его суммарной калорийности. Из рациона исключаются: газированные напитки, наваристые бульоны, жирные сорта мяса, копчености, острые, жареные и консервированные продукты, концентраты. Рекомендуется свежеприготовленная пища в тёплом отварном, паровом или тушенном виде. Лечебное питание назначается не менее чем на 1 год, а при сохранении длительно болевого синдрома – до 1,5-2 лет.
Особая роль в лечении дискинезий билиарной системы принадлежит желчегонным средствам, которые условно подразделяются на:
холеретики, стимулирующие образование желчи за счет усиления функциональной активности гепатоцитов. Это препараты, содержащие желчь: аллохол, холензим, лиобил; синтетические препараты: никодин, оксафеномид, циквалон; препараты растительного происхождения: экстракт кукурузных рылец, экстракт расторопши, артишок, дымянки, фламин, холагол, хофитол, холосас, гепабене, и др.
холекинетики, стимулирующие желчевыделение, вызывающие повышение тонуса желчного пузыря, снижение тонуса желчных путей и способствующие усиленному поступлению желчи в ДПК: сульфат магния, сорбит, ксилит.
Для купирования болевого синдрома применяют миотропные спазмолититки (галидор, дротаверин, баралгин, мебеверин, и др). Могут назначаться также холелитические средства (производные деоксихолевой кислоты), нормализующие выработку холестерина, и гепатопротективные средства, обладающие комплексным действием на гепатобилиарную систему (спазмолитическое, противовоспалительное и холеретическое).
Для улучшение оттока желчи хорошо проводить дюбажи по Демьянову (слепое зондирование), с сульфатом магния (0,2-0,4 г/кг), минеральной водой «Донатом магния», 1-2 раза в неделю (на курс до 4-8 процедур).
Достаточно часто дисфункции билиарного тракта являются следствием невроза. С этой целью показана вегетотропная терапия. Предпочтение отдается лекарствам растительного происхождения:
седативные препараты: корень валерианы, бром, пустырник, шалфей.
тонизирующие препараты: экстракт элеутерококка, настойка аралии, китайского лимонника, свежезаваренный чай и пр.
Профилактика дисфункциональных расстройства билиарного тракта заключается в назначении рационального питания, соблюдении режима питания, исключении стрессов, санации вторичных очагов инфекции, назначении дозированных физических нагрузок.
За детьми с дисфункциями билиарного тракта сроком на 2 года устанавливается диспансерное наблюдение. Ребёнок должен проходить профилактические курсы терапии в весенне-осенние периоды и в период ремиссии: фитотерапию, водолечение и бальнеолечение.
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Печеночная энцефалопатия


Предрасположенность
Клинические признаки
Диагностика
Лечение
Прогноз
Печеночная энцефалопатия – это патология, которая проявляется поражением нервной системы вследствие выраженной печеночной недостаточности, при утрате функционала печени более чем на 60%, или при такой аномалии развития, как портосистемный шунт.
У здорового животного печень является защитным фильтром, нейтрализующим нейротоксины, которые образуются в просвете кишечника и затем всасываются в кровь. При патологии печени нейротоксины с током крови доставляются к структурам нервной системы и вызывают поражение клеток коры головного мозга.
Первичный фактор, поражающий нервную систему — это аммиак, который не метаболизируется в полной мере.
Предрасположенность
Портосистемные шунты обычно диагностируются у молодых собак, у взрослых диагностируется при наличии сопутствующих заболеваний печени. Чаще заболевание встречается среди представителей следующих пород: йоркширский терьер, мальтийская болонка, ирландский волкодав, такса, миниатюрные шнауцеры, австралийская овчарка.
Нецирротическая портальная гипертензия встречается у доберманов.
Хронические гепатиты распространены среди собак пород вест-хайленд-уайт-терьер, коккер-спаниель, доберман-пинчер.
Аномалии метаболизма меди в печени отмечается у бедлингтон-терьеров.
Клинические признаки
Печеночная энцефалопатия может протекать в острой или хронической форме, что зависит от первичного заболевания, которое привело к данной патологии. Течение болезни бывает прогрессирующим (с постепенно нарастающей тяжестью симптомов) или эпизодическим.
- Изменения привычного поведения — питомец перестает адекватно реагировать на происходящее вокруг: отказывается от игр, прячется, ходит без какой-либо цели. Часто заметно снижение умственных способностей, изменение личности, угнетение, ступор. Эти признаки случаются эпизодично и обычно связаны с потреблением корма с высоким содержанием белка (проявляются через 1-3 часа после приема пищи). Иногда эти признаки нарастают постепенно, в течение нескольких дней, месяцев или даже лет.
- Вялость;
- Приступы судорог (также, как правило, после приема пищи);
- Полиурия/полидипсия (повышенное мочеиспускание и жажда);
- Периодическая рвота;
- Хроническая диарея;
- Отказ от корма, вялый аппетит
- Слюнотечение.
При более тяжелом течении заболевания (как правило, при длительно проявляющихся ранних клинических симптомах) могут наблюдаться более тяжелые проявления:
- цереброкортикальная слепота (потеря зрения, при которой зрачки слепого животного нормально реагируют на свет);
- общая слабость;
- тремор (дрожь);
- длительное слюнотечение (редко встречается у собак, чаще отмечается у кошек);
- угнетение сознания, вплоть до комы;
- тяжелые множественные эпилептические приступы (редко у собак, более распространено у кошек).
Диагностика
Необходимый минимум исследований при подозрении на печеночную энцефалопатию: общий клинический и биохимический анализы крови, тест на желчные кислоты, анализ мочи.
Тест на желчные кислоты выполняется дважды — первая проба натощак; вторая проба через 2 часа после кормления (анализ крови из вены).
Для гепатоэнцефалопатии характерно нормальное или увеличенное содержание желчных кислот в пробе натощак и значительное (в 6-10 раз выше нормы) повышение их уровня в сыворотке крови, взятой после кормления.
Биохимический анализ крови часто показывает гипоальбуминемию (сниженный альбумин), может быть умеренно повышена мочевина при нормальном или сниженном (при потере мышечной массы) уровне креатинина. Иногда отмечается гипокалиемия (снижение уровня калия). Может выявляться пониженный уровень холестерина в крови.
У животных с печеночными шунтами достаточно часто наблюдается микроцитарная анемия.
В моче могут наблюдаться кристаллы биурата аммония или формируются более крупные конкременты (камни). Камни этого типа (ураты) наиболее часто встречаются при портосистемных шунтах.
Дополнительные методы диагностики могут выявить изменения, характерные для патологии:
-
у животных с печеночными шунтами или с терминальной стадией цирроза может выявить значимое уменьшение размера печени; также может выявить уменьшение размеров печени, кроме того, УЗИ в некоторых случаях идентифицирует аномальные сосуды. Доплерография может выявить аномальный кровоток, однако не может рассматриваться как экспертный метод.
- Портография может показать наличие аномальных сосудов;
- МРТ печени также может показать портосистемные шунты;
- Биопсия ткани печени позволит определить первичное заболевание печени.
Симптомы, характерные для печеночной энцефалопатии, могут быть вызваны рядом других патологий, которые необходимо исключить при постановке диагноза.
Лечение
Один из основных способов лечения энцефалопатии (снижения клинических проявлений) — это контроль уровня мочевины и образования из нее аммиака в кишечнике. Низкий уровень рН (кислая среда) в кишечнике угнетает работу уреазы (фермента, который расщепляет метаболиты до токсических продуктов), уменьшает микрофлору, продуцирующуюу этот фермент, и снижает всасывание аммиака: большая его часть преобразуется в аммоний и выводится с калом.
Следующий важный фактор для уменьшения синтеза аммиака — это диета: смена источников и количества белков способствуют подавлению работы уреаз.
При лечении патологии применяется небольшое количество лекарственных препаратов в низких дозах.
Начальное лечение
Изначально лечение должно быть направлено на восстановление водно-электролитного и кислотно-щелочного баланса, а также, что крайне важно, на подавление синтеза и всасывания токсинов в ЖКТ. Выбор средств на начальном этапе лечения зависит от первопричины патологии. Если энцефалопатия связана с наличием портосистемного шунта, то показана хирургическая операция. Перед проведением хирургического лечения животное должно быть медикаментозно стабилизировано. При остром кризисе показана голодная диета. В дальнейшем животное необходимо кормить часто и понемногу. В качестве источника белка должны использоваться молочные продукты и растения. Для нормальной дефекации следует добавить в рацион водорастворимую клетчатку.
Доступны и могут быть рекомендованы коммерческие корма с низким содержанием белка (hill s k/d, royal canine renal и др.).
Также в терапии печеночной энцефалопатии применяются:
- Антибиотики (назначаются совместно с лактулозой) — для подавления бактерий в кишечнике, которые синтезируют уреазу и тем самым увеличивают концентрацию токсических соединений в просвете ЖКТ.
- Лактулоза (синтетический углевод).
- Клизмы для нормализации дефекации.
- Лекарственные препараты для подавления кровотечения в ЖКТ. Пациенты с этой патологией склонны к образованию язв в желудочно-кишечном тракте. Выделяющаяся при этом кровь — источник значительного количества протеина, из которого в кишечнике синтезируется аммиак. Необходимо проверить фекалии на присутствие паразитов и при необходимости использовать подходящий антигельминтик.
- Препараты для подавления рвоты: метоклопрамид, ондансетрон.
- Препараты для купирования судорожных приступов. У животного следует проверить уровни глюкозы и электролитов (кальций, калий, натрий). Все препараты требуют строгого контроля ветеринарного врача.
- Лекарственные препараты для снижения внутричерепного давления.
Поддерживающая терапия
Для поддержания водно-электролитного баланса важную роль играет инфузионная терапия. Дегидратация (недостаток жидкости в организме) вызывает увеличение концентрации мочевины в крови, что приводит обострению патологии (так как излишки мочевины поступают в кишечник, и из них синтезируется аммиак, который всасывается в кровь.
При недостаточном уровне альбумина рекомендуется переливание плазмы крови.
Прогноз
Прогноз определяется тяжестью первичного заболевания. Если патология печени поддается терапии, симптомы могут быть практически полностью обратимы. Однако при сопутствующих заболеваниях, в том числе инфекционных, прогноз ухудшается.
(с) Ветеринарный центр лечения и реабилитации животных «Зоостатус».
Варшавское шоссе, 125 стр.1. тел. 8 (499) 372-27-37
Холецистит первичное заболевание билиарной системы
Первичные заболевания билиарной системы недавно были признаны более распространенными, чем считалось ранее. Однако сообщения о них по-прежнему редки.
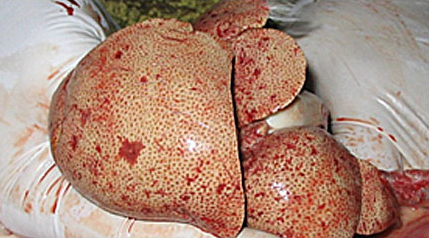
Заболевания желчного пузыря (калькулезный и некалькулезный холецистит, мукоцеле, желчнокаменная болезнь, неоплазия и др.) достаточно трудно диагностировать у собак и кошек на ранних стадиях, так как симптомы неспецифичны и часто ассоциированы с обструкцией и/или воспалением общего желчного протока, воспалительными заболеваниями печени и др. Поэтому ранее они выявлялись в запущенной форме и подтверждались во время операции и/или аутопсии.
Помимо прогрессирующего ухудшения состояния животного, тяжело протекающий холецистит может приводить к разрыву желчного пузыря и последующему желчному перитониту. Все это требует проведения более тщательной диагностики у пациентов с симптомами, указывающими на холецистит, и индивидуального подхода при выборе лечения.
Холецистит – это воспаление желчного пузыря. Согласно этиологии выделяют три категории повреждений желчного пузыря: обструктивные, необструктивные и разрывы пузыря и/или желчных протоков, а также острую и хроническую формы протекания заболевания.
Обструктивный холецистит развивается чаще всего вследствие сдавления пузырного протока и/или холедоха измененной поджелудочной железой (в этом случае заболевание можно считать вторичным), реже – развития мукоцеле, сгущения желчи, неоплазии кишечника, печени, билиарного тракта, диафрагмальной грыжи и еще реже – образования желчных камней.
Необструктивные формы холецистита чаще всего связаны с наличием инфекционного очага в организме или с паразитарными заболеваниями (печеночная двуустка, лямблиоз и др.). Описанная в гуманной медицине первичная дискинезия желчного пузыря и желчевыводящих протоков как причина развития холецистита в современных ветеринарных источниках литературы не встречается. Возможно, это связано со сложностями в верификации диагноза и выявлением причин и механизма ее развития (у людей – это нарушения гормональной регуляции, стрессы, язвенная и желчнокаменная болезнь, заболевания поджелудочной железы, применение препаратов, вызывающих застой желчи и спазм сфинктера Одди). Дискинезию вторичного генеза так или иначе мы можем предполагать и наблюдать при сонографии желчного пузыря (перерастяжение, образование осадка в полости), при аномалиях развития желчного пузыря (перегибы, стенозы, перетяжки, неполные перегородки в полости пузыря) и после перенесенного ранее холецистита.
Пневмохолецистит (эмфизематозный холецистит) вызывается газообразующими бактериями, такими как E.coli или Clostridium perfringens. Часто наблюдается в сочетании с острым холециститом, сахарным диабетом и на фоне травматической ишемии желчного пузыря.
Разрывы желчного пузыря могут происходить при серьезных травмах (ДТП, падение с высоты, удары) или в результате перфорации измененной стенки желчного пузыря при хронических воспалительных процессах.
Согласно WSAVA Liver Standardization Group среди заболеваний желчного пузыря выделяют нейтрофильный, лимфоплазмацеллюлярный, фолликулярный холециститы, мукоцеле и инфаркты желчного пузыря.
Нейтрофильный холецистит часто наблюдается у кошек и реже у собак и, в общем, ассоциирован с бактериальной инфекцией; может наблюдаться как самостоятельное заболевание или в комбинации с нейтрофильным холангитом. Повреждение характеризуется появлением в полости пузыря, эпителии и стенке желчного пузыря нейтрофилов, при хроническом течении – смешанного воспалительного инфильтрата, содержащего нейтрофилы, лимфоциты, плазматические клетки.
Лимфоплазмацеллюлярный и фолликулярный холецистит возникают в результате формирования лимфоплазмацетарного инфильтрата и/или лимфоидных фолликулов в слизистой желчного пузыря.
Инфаркт желчного пузыря возникает вследствие окклюзии пузырной артерии. Полный или частичный инфаркт желчного пузыря описан у собак. При гистологическом исследовании наблюдают некроз всей толщи стенки желчного пузыря без признаков сопутствующего холецистита и (часто) тромбоз артерий.
Клинические симптомы
В большинстве случаев холецистит наблюдается как острое заболевание. Владельцы отмечают у животного тошноту, рвоту, отказ от корма, боли в области живота. Желтуха является необязательным симптомом, особенно если общий желчный проток свободен, и может проявляться не сразу. Ее появление в этом случае объясняется развитием неспецифического реактивного гепатита и внутрипеченочного холестаза в ответ на эндотоксины из воспаленного желчного пузыря. Холецистит, сопровождающийся застоем желчи, может приводить к ахолии и обесцвечиванию каловых масс. Появление на фоне этих симптомов лихорадки, синдрома острого живота и признаков септического шока (поверхностное дыхание, гипотермия, бледные десна и слабый, но частый пульс) может указывать на разрыв желчного пузыря и требует неотложных мероприятий.
Холецистит может быть хроническим и проявляться периодической тошнотой у животного, признаками дискомфорта после еды, потерей аппетита, снижением веса, диареей или протекать вообще без каких-либо симптомов (а изменения в желчном пузыре будут случайной находкой при ультрасонографии).
Диагностика
Данные анамнеза и физикального осмотра позволяют лишь предположить у животного описываемую патологию, но не дают возможности поставить диагноз. К тому же клиническая картина не отражает в полной мере степень поражения желчного пузыря, а соответственно, не позволяет определить наилучший способ лечения и прогноз заболевания.
На первом этапе диагностики обязательны клинический и биохимический (как можно более полный) анализы крови, факультативным исследованием является моча. Лабораторные тесты позволяют выявить увеличение щелочной фосфатазы, гиперхолестеролемию, гипербилирубинемию без признаков гемолитической анемии. Гипербилирубинемия приводит в конечном счете к билирубинурии. Повышение уровня желчных кислот, глутаматдегидрогеназы и лейкоцитоз очень характерны для данной патологии и дополнительно указывают на необходимость исследования желчи. Повышение трансаминаз будет выявлено только в случае вовлечения паренхимы печени в воспалительный процесс.
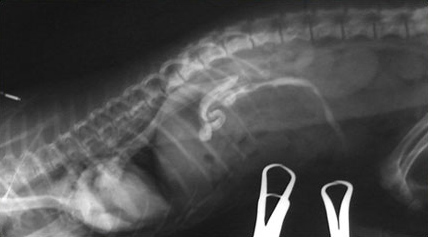
При выборе метода диагностики непосредственно холецистита предпочтение отдается визуальным исследованиям и преимущественно ультразвуковой диагностике. Рентгенография оказывается менее чувствительной при данной патологии и информативна только в случае кальцификации стенки желчного пузыря или формирования рентгеноконтрастных камней (Фото 6 и 7).
Фото 6 и 7.
В данном разделе мы рассмотрим изменения ультразвуковой картины желчного пузыря и билиарной системы, наблюдаемые при холецистите, не затрагивая возможные изменения поджелудочной железы, неоплазии других органов и т. д.
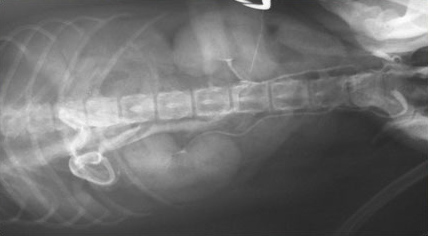
- Стенка желчного пузыря утолщается (толще 1 мм у кошек и 2-3 мм у собак), становится гиперэхогенной, с неровными краями – признак воспаления, отека (портальная гипертензия, гипоальбуминемия), некроза, гиперплазии слизистой пузыря, реже – неоплазии (Фото 1);
- Наряду с утолщением стенки часто отмечают появление двухконтурного ободка (особенно в более остром периоде) или диффузно гиперэхогенной стенки, иногда сочетающейся с минерализацией (при хронически протекающем процессе) (Фото 2 и 3);
- Утолщение стенки и дилатация просвета общего желчного протока, повышение его извитости. Однако бывает достаточно сложно дифференцировать дилатацию просвета на фоне обструкции от дилатации на фоне холестаза при хроническом воспалительном процессе. Кроме того, при хроническом нарушении оттока общий желчный проток может оставаться дилатированным даже после устранения обструкции (это необходимо учитывать в постоперационном обследовании);
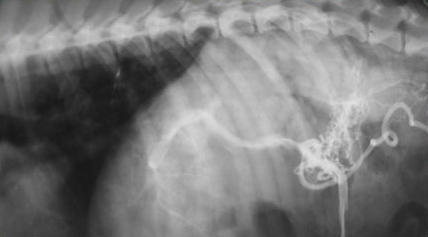
- Появление желчного сладжа. Физиологически желчь может уплотняться и преобразовываться в желчный сладж (желчную грязь). Он представляет собой смесь слизи, билирубината кальция и кристаллов холестерина. В патологических условиях его консистенция и аккумуляция могут осложнить эвакуацию желчи во внепеченочные желчные протоки, что ведет к обструкции последних. Характерный признак желчного сладжа – изменение его вида на сканограмме в зависимости от изменения положения тела животного и медленное достижение нового горизонтального уровня (критерий подвижности сладжа позволяет отличить его от билиарного мукоцеле). Общим правилом является отсутствие дистальной акустической тени. Эхогенность сладжа может быть различной. Иногда сладж заполняет весь желчный пузырь, затрудняя дифференцировку между тканью печени и желчным пузырем. Эта ситуация называется «гепатизация желчного пузыря» (Фото 4 и 5);
- Желчное мукоцеле (муцинозная гиперплазия желчного пузыря) – характеризуется гиперплазией эпителия и сосочковыми разрастаниями, избыточным накоплением слизи, растягивающей желчный пузырь. Заболевание встречается редко, как правило, у собак мелких и средних пород (средний возраст — 9 лет). Является одной из причин развития обструкции внепеченочных желчных протоков и как следствие холецистита. По мере того, как формируется мукоцеле, на сканограмме вначале появляется звездчатый контур, затем поперечный срез желчного пузыря приобретает рисунок киви (фрукта) в поперечном сечении.
Фото 1 и 2.
Фото 3 и 4.
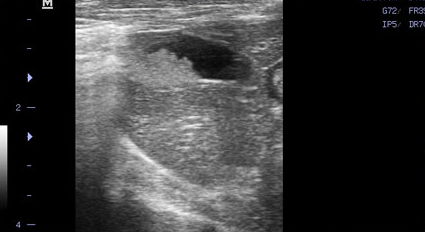
Фото 5.
При любом изменении желчного пузыря или появлении неоднородности желчи на УЗИ необходимо проводить тонкоигольную биопсию с целью аспирации желчи для цитологического и бактериологического исследований. Для этого можно использовать иглы 22-25-го номеров, и при проведении данной процедуры необходимо удалить столько желчи, сколько возможно, для предотвращения просачивания желчи через пункционное отверстие. Вероятность подобного осложнения крайне мала, в своей практике мы такого не встречали, но при наличии недиагностированной вовремя обструкции внепеченочных билиарных трактов риск повышается. Также мы рекомендуем проводить забор материала паренхимы печени для гистологического исследования (процедура забора биоптата для гистологического исследования усложняется ненамного в сравнении с тонкоигольной биопсией печени, но результат во много раз информативнее).
Одним из современных информативных методов является радионуклидное сканирование желчного пузыря (сцинтиграфия), которое позволяет оценить работу желчного пузыря, определить место обструкции протока. К сожалению, в нашей практике этот метод пока недоступен.
При подозрении на желчный перитонит показана диагностическая лапароскопия или лапаротомия.
Лечение
Выбор между терапевтическим и хирургическим методом лечения при данном заболевании осуществляется на основании комплексной оценки состояния животного, наличия сопутствующих заболеваний в анамнезе, наличия заболеваний, спровоцировавших развитие холецистита и, конечно, тяжести и длительности данного заболевания, эффективности предыдущего лечения, если оно проводилось, и появления рецидивов.
Нет смысла проводить консервативное лечение и ждать улучшения картины заболевания у животного в критическом состоянии, идя на поводу у его владельцев, стремящихся сохранить орган. Без воспаленного желчного пузыря животное прекрасно сможет жить. В то же время, если обстоятельства позволяют, можно и нужно проводить интенсивную медикаментозную терапию, во многих ситуациях – успешную.
Итак, если к нам обращается владелец кошки или собаки, у которой наблюдаются вышеперечисленные симптомы и при этом состояние животного удовлетворительное, отсутствует лихорадка, кахексия и безудержная рвота, анализы крови указывают на воспалительный процесс, а УЗИ выявляет необструктивный холецистит, возможно, с незначительным количеством желчного сладжа в полости, то мы осуществляем следующие действия:
- назначаем диету. Удобно для этого использовать промышленные корма при заболеваниях печени, так как в домашних условиях достаточно сложно приготовить механически и химически не раздражающую пищу.
- проводим адекватную антибиотикотерапию (предварительно взяв желчь для бакпосева). В случае, если посев окажется стерильным, – это будет отличной профилактикой вторичной инфекции. Бактериальный, в том числе эмфизематозный, холецистит требует долгосрочного применения антибиотиков:
амоксициллин/ампициллин (10-22 мг/кг каждые 8-12 часов, в/м) или препараты цефалоспоринового ряда (цефоперазон 50 мг/кг каждые 12 часов, в/в или в/м; цефалоспорины 4 -го поколения – цефкином (Кобактан, MSD AnimalHealth)- 0,5 мл/ 5 кг массы один раз в день в/м) и/или метронидазол (15-25 мг/кг каждые 12 часов, в/в) для грамположительной флоры и анаэробов (С.perfringens) на 14-21 день и фторхинолоны для грамотрицательных бактерий (E.coli и др.). Например, энрофлоксацин 5-20 мг/кг в день, п/к, на 10-14 дней.
По результатам антибиотикограммы после посева лечение необходимо корректировать. для улучшения свойств желчи и наилучшего ее отхождения мы назначаем урсодезоксихолевую кислоту (4-15 мг/кг в день, внутрь, лучше всего делить суточную дозу на два приема, в течение нескольких месяцев) и одестон (гимекромон). - при необходимости проводится терапия первичного или сопутствующего заболевания, инфузионная терапия, назначаются спазмолитические средства.
В том случае, если животное находится в критическом состоянии из-за остро развившегося холецистита, или мы имеем дело с рецидивирующим холециститом, или у нас есть все основания предполагать обструктивный холецистит и/или разрыв желчного пузыря и/или холедоха, проводим хирургическое лечение. Выбор метода хирургической коррекции зависит от предполагаемой патологии, возможностей клиники и опыта врача, проводящего манипуляцию. В последнее время холецистэктомия в нашей клинике проводится исключительно лапароскопически, что позволяет снизить травматичность операции, минимизировать осложнения и ускорить восстановительный период. При этом мы обязательно проводим контрастирование желчного пузыря, чтобы убедиться в проходимости желчных путей, и осуществляем промывание холедоха. К сожалению, ввиду анатомических особенностей у кошек и собак на сегодняшний день невозможно использовать эндоскопическую ретроградную холангиопанкреатографию для этих же целей, поэтому используем более инвазивные методы. Конечно, в ситуациях, связанных с разрывом желчного пузыря или обструкцией холедоха, мы прибегаем к классическому способу – лапаротомии. Вариантов операций на желчном пузыре несколько, и выбор хирурга определяется состоянием желчного пузыря, развившейся патологией и т. д. Но для этой темы требуется отдельная статья, поэтому здесь она будет опущена.
Перед проведением операции необходимо убедиться в отсутствии нарушений свертывающей системы крови. Этому могут способствовать длительный застой и нарушение оттока желчи (появляется дефицит витамина К, снижается уровень факторов коагуляции II, VII, IX и X). Поэтому проводят дополнительный анализ крови – коагулограмму. Для предотвращения возможной коагулопатии дополнительно вводят конакион (витамин К1) в дозе 1-2 мг/кг подкожно, этого достаточно для нормализации коагуляции в течение 3-12 часов после введения.
При сопутствующей желтухе у пациентов необходимо помнить об их предрасположенности к гипотонии в послеоперационном периоде и возможном развитии почечной недостаточности.
Ткани удаленного желчного пузыря обязательно отправляются в лабораторию для гистологического исследования.
Следует отметить, что до сих пор о проведении холедохотомии при обструктивных патологиях ведутся споры. Это опять же связано с особенностями анатомии наших пациентов, а точнее с малыми размерами структур билиарного тракта и большим числом описываемых осложнений (негерметичность швов, стенозы в послеоперационном периоде, высокая смертность при проведении подобных операций и др.). Опыт нашей клиники и сообщения S. G. Baker, P. D. Mayhew, S. J. Mehler (Journal of Small Animal Practice, Volume 52, Issue 1, pages 32-37, January 2011) позволяют говорить о низком уровне осложнений при данных операциях и требуют дальнейших разработок.
Прогноз заболевания условно благоприятный, при адекватно проведенном лечении функция желчного пузыря будет полностью сохранена. Наибольшую опасность могут представлять осложнения, связанные с разрывом желчного пузыря и возникновением перитонита. В случае его развития даже при адекватном лечении возможен летальный исход. Также необходимо уделять большое внимание наблюдениям лечащего врача, так как клиническая динамика имеет свои особенности в каждом конкретном случае.
Холестаз у собак
Холестаз у домашних животных – патология, характеризующаяся застоем желчи в желчном пузыре по причине закупорки желчевыводящих протоков. В нормальных условиях щелочная жидкость, продуцируемая печенью и накапливающаяся в специальном пузыре, находит свой выход в верхней части тонкого отдела кишечника – двенадцатиперстной кишке.
Желчь – важная жидкость, играющая особую роль в процессах пищеварения и выводя токсических веществ и организма животного. Образовавшаяся в печеночных структурах щелочная жидкость, скапливается в пузыре, и находиться там до момента, пока пищевой ком не проникнет в желудок. Начинается процесс выхода желчи через специальные протоки. Именно желчные кислоты, содержащиеся в желчи, необходимы для нормального прохождения процессов переваривания пищи и всасывания полезных веществ.
Застой желчи в желчном пузыре или холестаз, развивается у собак в результате воздействия различных факторов, среди которых лидирующие места занимают патологии печеночных структур, самого желчного или же воспалительные процессы в области поджелудочной железы. Например, генетическую предрасположенность к развитию воспалений в области поджелудочной, имеют шотландские овчарки, поэтому у них риски развития застоя желчи достаточно высоки.
Холестаз характерен для животных в старшем и пожилом возрасте, реже диагностируется у молодых собак. Половой предрасположенности к развитию патологии не наблюдается.
Причины заболевания

Спровоцировать развитие холестаза у домашнего питомца способно множество факторов. Но в ветеринарной практике выделяют следующий ряд причин:
- наличие желчнокаменного заболевания (образование конкрементов в пузыре);
- аномальное разрастание тканей желчного пузыря и протоков (может быть доброкачественного или злокачественного типа);
- воспалительные процессы в области поджелудочной железы (панкреатиты);
- механические повреждения желчевыводящих протоков в результате сильного удара или же на фоне хирургических вмешательств в области живота.
Симптомы холестаза у собак
В зависимости от основной причины, спровоцировавшей развитие патологии, признаки холестаза могут видоизменятся. Основными симптомами развития застоя желчного секрета у собак, на которые должен обратить внимание владелец, являются:
-
, даже после незначительных физических нагрузок;
- изменение окраса видимых слизистых оболочек (иктеричность или желтуха);
- изменение аппетита – животное не может насытиться; ;
- изменение консистенции и характеристик каловых масс (может возникать понос с прожилками крови, светлого оттенка);
- изменение окраса урины – моча приобретает насыщенный оранжевый цвет, что указывает на присутствие большого количества билирубина.
Лечение и профилактика патологии
Ветеринарный специалист при обращении к нему владельца собаки с рядом характерных симптомов, назначает проведение диагностических мероприятий. Это необходимо для постановки точного диагноза, определения причины развития холестаза и подбора максимально адекватной схемы терапии.
Врач проводит общий клинический осмотр пациента, собирает анамнез, а также назначает проведение лабораторных исследований. Самым важным является биохимический анализ крови, далее по значимости идет анализ мочи и крови. У большинства собак при холестазе, диагностируется малокровие или железодефицитная анемия.
Уровень содержания продуктов метаболизма в крови, является показательным при составлении дальнейшей тактики лечения. Так, важный показатель в биохимической панели – уровень билирубина. Это специфический пигмент, окрашенный в яркий красный цвет, отделяемый от эритроцитов при их разрушении. Билирубин неотъемлемый компонент желчного секрета и крови. При нормальном функционировании организма, билирубин расщепляется на стеркобилин (придающий специфический коричневый окрас каловым массам) и уробилин (окрашивающий мочу в желтый цвет). Не расщепленный в процессе билирубин при закупорке желчевыводящих протоков, находиться в кровяном русле, провоцируя развитие желтухи. При этом каловые массы становятся бесцветными, а кожные покровы, склера глаз – приобретает выраженный желтый оттенок.
При холестазе биохимический анализ крови позволяет определить количество энзимов печени (они повышены). Патологии печени нередко сопровождаются проблемами в факторах свертываемости крови.
Помимо лабораторных исследований в ветеринарной практике используют инструментальную диагностику. Больному животному с подозрением на закупорку желчевыводящих протоков, назначают прохождение рентгенографии и ультразвуковой диагностики органов брюшной полости.
Некоторые случаи развития холестаза, невозможно диагностировать без хирургической манипуляции – лапаротомии. Малоинвазивная методика исследования проводиться не во всех клиниках, но имеет ряд преимуществ. Если во время проведения исследования с целью диагностики будет обнаружена патология, ее можно оперативно устранить.
Терапия закупорки желчных ходов зависит от основных причин, спровоцировавших заболевание.
Лечение всегда комплексное, подбирается с учетом особенностей пациента, тяжести протекания патологии и общего состояния здоровья животного.
При развитии обезвоживания, назначаются капельницы с физраствором и глюкозой. В подавляющем большинстве случаев, рекомендуется проведение хирургического вмешательства. После операции назначается курс антибиотиков и препаратов для поддержания работы печени (гепатопротекторов).
Несвоевременно начатая терапия грозит серьезными последствиями для дальнейшего нормального функционирования организма. До момента выздоровления, ветеринарные специалисты рекомендуют переводить собак на специальные лечебные диетические корма.
Если непроходимость желчных путей связана с развитием опухолей злокачественного характера, прогноз осторожный, чаще неблагоприятный.

В связи с большим потоком поступающих вопросов, бесплатные ветеринарные консультации временно приостановлены.
Печеночная энцефалопатия (гепатоэнцефалопатия)
Печеночная энцефалопатия (гепатоэнцефалопатия) — потенциально обратимое расстройство нервной системы, обусловленное метаболическими расстройствами, возникающими в результате печеночно-клеточной недостаточности и/или портосистемного шунтирования крови.
Механизмы появления и развития печеночной энцефалопатии на сегодняшний день остаются неясными. Обычно наблюдается сложный комплекс нарушений, ни одно из которых не дает исчерпывающего объяснения. Известно, что заболевание развивается при ряде синдромов – острой печеночной недостаточности, циррозе печени, липидозе печени у кошек, врожденных портоковальных анастомозов, важную роль играет также печеночно-клеточная (паренхиматозная) недостаточность.
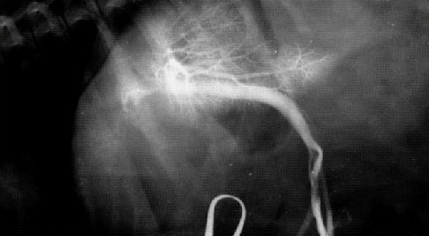
Рис.1. У таксы в возрасте 2-х лет асцит, гипертрофия правой доли печени, отсутствие кровотока в правой медиальной и левой латеральной доли.
Хроническая гепатоэнцефалопатия наблюдается у больных животных с портокавальным шунтированием или с патологией портальной вены (гепатопортальная микроваскулярная дисплазия). (Рис.1).
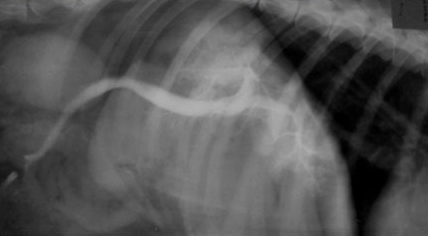
Рис.2.На снимке нарушение портального кровотока у собаки породы тоса-ину.
Различные симптомы печеночной энцефалопатии, вероятно, отражают количество и тип образующихся метаболитов. Кома при острой печеночной недостаточности часто сопровождается психомоторным возбуждением и отеком мозга. Для печеночной энцефалопатии характерны заторможенность и сонливость, иногда понижение температуры тела, повреждение астроцитов, нарушение гематоэнцефалического барьера, что в свою очередь может привести к осложнениям воспалительного характера в центрольной нервной системе.
Клиническая картина
При печеночной энцефалопатии поражаются практически все отделы головного мозга, поэтому клиническая картина представляет собой комплекс различных синдромов, включающих в себя неврологические и психические нарушения.
Разнообразие клинических симптомов при гепатоэнцефалопатии связано с повреждением глутаматных рецепторов. Глутамат синтезируется в нейронах из своего предшественника глутамина, накапливается в синаптических везикулах и в итоге высвобождается при помощи кальций-зависимого механизма. Высвободившийся глутамат может взаимодействовать с глутоматными рецепторами любого типа, находящимися в синаптической щели. В астроцитах под действием глутаминсинтетазы из глутамата и аммиака синтезируется глутамин. Развивающееся при гепатоэнцефолопатии нарушения включают увеличение содержания аммиака в головном мозге, приводят к повреждению астроцитов, уменьшению числа глутаматных рецепторов. Гепатоэнцефалопатия может проявляться по-разному. Могут быть повышены глубокие сухожильные рефлексы и мышечный тонус на некоторых стадиях. Возможны судороги, мышечные подергивания, у некоторых пациентов нарушается координация движений, состояния ухудшается после приема пищи. Во время комы рефлексы ослаблены и постепенно исчезают. Наблюдаются вялость, сонливость, понижение температуры тела.
Исследование спинномозговой жидкости
Специфических изменений в ликворе при гепатоэнцефалопатии не обнаружено.
Возможно повышение глутамина.
Электроэнцефалография
При гепатоцеребральной дистрофии у большинства пациентов при ЭЭГ-исследовании наблюдаются изменения в виде медленных волн, могут быть высокоамплитудные дельта волны, эпилептическая активность. Этот метод помогает при диагностике печеночной энцефалопатии и оценке результатов лечения, особенно на ранних этапах до появления клинических симптомов. Они неспецифичны и могут проявляться при других патологических состояниях, например при уремии.
Клинические варианты печеночной энцефалопатии
Острая энцефалопатия может развиться спонтанно под воздействием предрасполагающих факторов, особенно у больных с билирубинемией и асцитом после удаления большого количества жидкости, что, по-видимому, связано с потерей воды и электролитов. Богатая белками пища или длительные запоры могут способствовать развитию комы, а угнетение функции печеночных клеток вызвано анемией и снижением печеночного кровотока.
Пациенты с острой энцефолопатией плохо переносят хирургические операции, поскольку из-за кровопотери, анестезии и шока происходит усугубление нарушений функции печени. Развитию печеночной энцефолопатии могут способствовать инфекционные заболевания особенно в тех случаях, когда они осложняются бактериемией.
Хроническая энцефалопатия
Развитие хронической гепатоэнцефолопатии обусловлено значительным портосистемным шунтированием. Шунты могут быть врожденными (наиболее часто встречаются у йоркширских терьеров), приобретенными, могут состоять из множества мелких анастомозов, развившихся у больного циррозом печени или из крупного коллатерального сосуда. Выраженность гепатоэнцефолопатии зависит от содержания белка в пище. В этом случае постановка диагноза может вызвать затруднения. Диагноз становится очевидным, если при переходе на низкобелковую диету состояние пациента улучшается.
Данные энцефалографии могут помочь в постановке диагноза.
Гепатоцеребральная дегенерация ( Миелопатия) развивается после длительной хронической печеночной энцефолопатии и связана с очаговыми повреждениями головного мозга. Могут наблюдаться эпилептические припадки, нарушение двигательной функции, развиться синдром поражения мозжечка и базальных ядер мозга.
Патогенез
Метаболическая теория развития гепатоэнцефолопатии основывается на обратимости ее основных расстройств при обширных церебральных нарушениях. Не существует единственного метаболического нарушения, вызывающего гепатоэнцефолопатию.
В основе ее лежат снижение печеночного клиренса образующихся в кишечнике веществ как вследствие печеночно-клеточной недостаточности, так и за счет значительного шунтирования, а также нарушение метаболизма аминокислот. Оба эти механизма ведут к нарушениям в церебральных нейротрансмиттерных системах.
В патогенезе гепатоэнцефолопатии участвуют несколько нейротоксинов, особенно аммиак, и несколько нейромедиаторных систем, взаимодействующих между собой.
У каждого больного, находящегося в состоянии комы или прикомы, кровь может попадать из воротной вены в системные вены, минуя печень и не проходя детоксикацию.
У больных с нарушением функции гепатоцитов, например при остром гепатите, кровь шунтируется внутри печени. Поврежденные гепатоциты не в состоянии в полной мере проводить детоксикацию крови портальной системы, поэтому кровь поступает в печеночные вены с токсинами. При циррозе кровь из воротной вены минует печень по большим естественным коллатералям, поступает в системные вены. Кроме того, в пораженной циррозом печени вокруг долек образуются портопеченочные венозные анастомозы, которые функционируют как внутрипеченочные шунты.
Аммиак и глутамин
В патогенезе гепатоэнцефалопатии аммиак — наиболее изученный фактор. Аммиак выделяется при расщеплении белков, аминокислот, пуринов и пиримидинов. Около половины аммиака, поступающего из кишечника, синтезируется бактериями, а оставшаяся часть образуется из белков пищи и глутамина. В норме в печени аммиак превращается в мочевину и глутамин. Нарушение цикла мочевины ведут к развитию энцефолопатии. Уменьшение количества мочевины в крови может служить показателем развивающейся гепатоэнцефолопатии. Уровень аммиака повышен в крови у 90% пациентов. Содержание его в головном мозге может быть тоже увеличено. При пероральном получении солей аммония у некоторых больных может развиться гепатоэнцефолопатия.
Сама по себе гипераммониемия связана со снижением проведения возбуждения в ЦНС. Интоксикация аммиаком ведет к развитию гиперкинетического предсудорожного состояния. При гепатоэнцефолопатии основные механизмы действия аммиака заключаются в прямом воздействии на мембраны нейронов или на постсинаптическое торможение и в опосредованном нарушении функций нейронов в результате влияния на глутаматергическую систему.
Роль глутамата в центральной нервной системе
L-глутамат — главный возбуждающий медиатор в мозге животных. Глутамат обнаруживается во всех отделах ЦНС, т.к. он является не только нейромедиатором, но и предшественником других аминокислот. Тела глутаматергических нейронов находятся в коре больших полушарий, обонятельной луковице, гиппокампе, черной субстанции, мозжечке, сетчатке. Глутаматергические синапсы существуют в миндалине, стриатуме, на клетках-зернах мозжечка. Основные нисходящие пути идут от пирамидных клеток новой коры и гиппокампа. Эти тракты включают в себя кортиокстриарный, энторинально-гиппокампальный, а также гиппокампальные и корковые пути к различным гиппокампальным, таламическим и стволовым ядрам.
Глутамат — заменимая аминокислота, не проникает через ГЭБ, не поступает в мозг через кровь. Синтез осуществляется в мозге, в основном внутринейронально, хотя малая доля общего пула глутамата находится в астроцитах. Глутамат может быть синтезирован из альфа-кетоглутарата путем прямого восстановительного аминирования или трансаминирования, из глутамина (катализатор — глутаминаза), а также из орнитина (катализатор — орнитинаминотрансфераза).
Синтез глутамата из альфа-кетоглутарата катализируется глутаматдегидрогеназой: aльфа-кетоглутарат + NADH(NADPH)+NH3 глутамат + H2O + NAD+(NADP+)
Синтез глутамата из глутамина катализируется глутаминазой, локализованной в митохондриях. Активность этого фермента в мозге невелика, но предполагается участие его в мембранном транспорте глутамата (биологические мембраны более проницаемы для глутамина). Глутаминаза играет важную роль в регуляции содержания глутамата в нервных окончаниях (Ашмарин и др., 1999).
Помимо основной роли возбуждающего нейромедиатора, глутамат может проявлять нейротоксические свойства. При гиперактивации глутаматергической передачи происходит интенсивное поступление ионов кальция в клетку. Повышенное содержание свободного кальция способно индуцировать процессы образования реактивных форм кислорода. Следствием этих процессов может стать повреждение и гибель нейронов.
Глутаматсвязывающая активность обнаружена практически во всех структурах мозга. Наибольшее количество участков связывания находится в коре больших полушарий, гиппокампе, стриатуме, среднем мозге и гипоталамусе.
Глутаматные рецепторы подразделяются на ионотропные и метаботропные. Существует несколько подтипов глутаматных рецепторов. Современная класификация ионотропных рецепторов основана на разной их чувствительности к действию N-метил-D-аспарагиновой (NMDA), 2-амино-3(3-гидрокси-5-метилизоксазол-4-ил)пропионовой (АМРА), каинатной и квисквалатной кислот. Выделяют две группы рецепторов: NMDA и не-NMDA (их подразделяют на АМРА и каинатные).
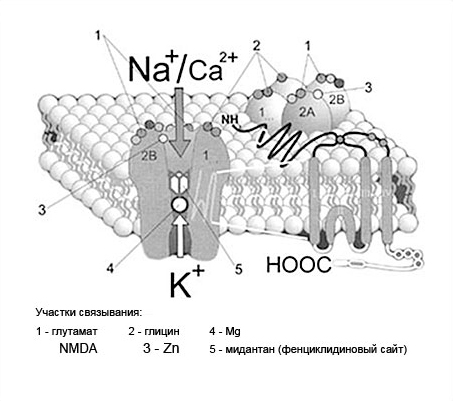
Рис.3. Структура NDMA-рецептора.
NMDA-рецепторы (рис.3) состоят из пяти субъединиц, по 40-92 кД каждая, (одной NMDAR1 и четырех NMDAR2A-NMDAR2D).
Эти субъединицы являются гликопротеидлипидными комплексами. Собственно, говоря, NMDA-рецептор представляет из себя целый рецепторно-ионофорный комплекс, включающий в себя:
1. сайт специфического связывания медиатора (L-глутаминовой кислоты);
2. регуляторный, или коактивирующий сайт специфического связывания глицина;
3. аллостерические модуляторные сайты, расположенные на мембране (полиаминовый) и в ионном канале (сайты связывания фенциклидина, двухвалентных катионов и потенциалзависимый Mg2+-связывающий участок).
NMDA-рецепторы обладают рядом особенностей: одновременно хемо- и потенциал-чувствительностью, медленной динамикой запуска и длительностью эффекта, способностью к временной суммации и усилению вызванного потенциала. Наибольшие ионные токи при активации агонистами возникают при деполяризации мембраны в узком диапазоне -30- -20 мВ (в этом проявляется потенциалзависимость NMDA-рецепторов)(Jose et al., 1996). Ионы Mg2+ селективно блокируют активность рецепторов при высокой гиперполяризации или деполяризации. Глицин в концентрации 0,1 мкМ усиливает ответы NMDA-рецептора, увеличивая частоту открывания канала. При полном отсутствии глицина рецептор не активируется L-глутаматом (Сергеев П. В и др., 1999).
NMDA-рецепторы и вовлечены в формирование долговременной потенциации (LTP). Известно, что NMDA-рецепторы играют важную роль в процессах обучения и памяти. Они участвуют в формировании долговременной потенциации в гиппокампе. Существуют данные о вовлечении NMDA-рецепторов в процессы пространственного обучения (Ahlander et al., 1999; Whishaw and Auer, 1989). Показано, что при системном введении неконурентный блокатор NMDA-рецепторов, МК-801, нарушает обучение в водном лабиринте(Gorter and de Bruin, 1992).
Большое внимание в настоящее время уделяется роли NMDA-рецепторов в развитии шизофрении. Предполагается, что протекание этого заболевания частично связано со снижением эффективности глутаматергической передачи. Так, блокада NMDA-рецепторов неконкурентным антагонистом фенцклидином приводила к возникновению симптомов этого заболевания. Нарушения функции NMDA-рецепторов коррелируют с мнестическими расстройствами и изменениями социального поведения, наблюдаемыми у больных шизофренией (Parsons et al., 1998).
Каинатные рецепторы осуществляют быструю глутаматергическую передачу, участвуют в пресинаптическом контроле высвобождения медиатора. АМРА-рецепторы также осуществляют быструю передачу и работают синергично с NMDA-рецепторами (Ozawa et al.,1998).
Метаботропные глутаматные рецепторы связаны с G-белковым комплексом и модулируют уровень продукции вторичных мессенджеров. Выделяют три группы рецепторов. Рецепторы группы I mGluR1 и 5 активируют фосфолипазу С, что ведет к активации внутриклеточных посредников: инозитолтрифосфатов, протеинкиназы С и ионов кальция. Рецепторы групп II и III mGluR2, 3 и mGluR4,6,7,8 реализуют сигнал, подавляя синтез цАМФ (Ашмарин и др.,1999).
В головном мозге цикл мочевины не функционирует, поэтому удаление из него аммиака происходит различными путями. В астроцитах под действием глутаминсинтетазы из глутамата и аммиака синтезируется глутамин. В условиях избытка аммиака запасы глутамата ( важного возбуждающего медиатара ) истощаются и происходит накопление глутамина. Содержание глутамина и альфакетаглутарата в спинномозговой жидкости коррелирует со степенью гепатоэнцефалопатии. Трудно оценить вклад аммиака в развитие гепатоэнцефолопатии, так как при этом состоянии наблюдается изменение в других нейромедиаторных системах. У 10% пациентов уровень аммиака нормальный. Производные метионина, особенно меркаптаны, вызывают гепатоэнцефалопатию, поэтому использование метионина в качестве лекарственного препарата недопустимо. Имеются данные, что при гепатоэнцефолопатии некоторые токсины, такие как аммиак, жирные кислоты, фенолы, меркаптаны, действуют как синергисты.
Ложные нейротрансмиттеры
При гепатоэнцефолопатии передача импульсов в катехоламиновых и допаминовых синапсах головного мозга подавляется аминами, образующимися под действием бактерий в кишечнике при нарушении метаболизма предшественников нейромедиаторов в головном мозге. Декарбоксилирование в кишечнике некоторых аминокислот ведет к образованию беттафенилэтиламина, тирамина и октопамина-ложных нейротрансмиттеров. Они замещают истинные нейромедиаторы. Изменение доступности предшественников медиаторов препятствует нормальной нейропередачи.
У больных с заболеваниями печени возрастает содержание в плазме ароматических аминокислот- тиразина, фенилаланина, триптофана, что обусловлено нарушением их дезаминирования в печени. Одновременно понижается содержание аминокислот с разветвленной цепью — валина, лейцина, изолейцина, связанное с увеличением их метаболизма в скелетных мышцах и почках в результате гиперинсулинемии, характерной для больных с хронической печеночной недостаточностью. Эти две группы аминокислот конкурируют за прохождение в головной мозг. Нарушение их соотношения в плазме позволяет ароматическим аминокислотам проникнуть через нарушенный гематоэнцефалический барьер. Высокий уровень фенилаланина в головном мозге приводит к подавлению синтеза допамина и образованию ложных нейротрансмиттеров: фенилэтаноламина и октопамина.
При заболеваниях печени повышается содержание триптофана в спинномозговой жидкости и головном мозге. Триптофан является предшественником нейромедиатора серотонина. Серотонин участвует в регуляции уровня возбуждения коры головного мозга и цикла сон-бодрствования. При гепатоэнцефолопатии наблюдаются другие нарушения метаболизма серотонина. Является ли нарушение в этой системе первичным дефектом, нуждается в дальнейшем изучении.
Тяжесть гепатоэнцефалопатии коррелирует с бензодиазепиновой активностью плазмы крови и мочи. В кале больных циррозом печени активность бензодиазепиновых соединений в пять раз выше. Повышение чувствительности к бензодеазипинам подтверждает участие этой нейромедиаторной системы в развитии гепатоэнцефалопатии.
Другие метаболические нарушения
При гепатоэнцефолопатии может развиться гипогликемия. По мере усугубления печеночной недостаточности наблюдается прогрессирующее нарушение обмена углеводов. Мозг при гепатоэнцефолопатии становится чувствителен к воздействию вредных факторов: опиатов, электролитных нарушений, сепсису, артериальной гипотензии, гипоксии, что не отмечается в норме. Ветеринарный врач должен обязательно учитывать это при проведении операций и введении в наркоз пациентов с таким заболеванием.
Лабораторная диагностика гепатоэнцефалопатии
Биохимические и гематологические показатели, полученные в результате рутинных тестов, дают возможность лишь предполагать наличие гепатоэнцефалопатии. Наиболее полезными в этом отношении являются тест на концентрацию аммиака в крови, проверка толерантности к аммиаку, проверка содержания желчных кислот в сыворотке. Гематологические показатели у животных с гепатоэнцефалопатией не являются специфическими и могут включать слабую анемию, пойкилоцитоз, микроцитоз.
Подобно этому, изменения сывороточных концентраций биохимических показателей, ассоциированных с болезнями печени (АЛТ, ACT, альбумин, билирубин, глюкоза и калий), обычно не специфичны, сочетание низкого альбумина, низкой мочевины может говорить о наличии поражений печени, вызывающих гепатоэнцефалопатию. Концентрация в крови азота мочевины обычно очень низка (менее 6 мг/100 мл).
У животных с гепатоэнцефалопатией наблюдается дыхательный и метаболический алкалоз. Дыхательный алкалоз является вторичным по отношению к гипервентиляции, а метаболический алкалоз является результатом гипокалиемии и сильной рвоты.
Концентрация аммиака в крови обычно оценивается в образцах крови, взятой из артерии, и сыворотка должна быть отделена от клеток в течение 30 мин. Следует подчеркнуть, что степень серьезности неврологических признаков не всегда связана со степенью гипераммонизации. Некоторые энцефалопатические животные имеют нормальную концентрацию аммиака в крови, в то время как у других животных с минимальными неврологическими расстройствами наблюдается значительное повышение концентрации аммиака. Если повышенная концентрация аммиака (более 120 мкг/100 мл для собак) будет обнаружена спустя, по крайней мере, 6 часов после приема пищи, это будет иметь большое значение для постановки диагноза.
Для проверки толерантности к аммиаку измеряют разницу между величинами концентрации аммиака per os перед приемом и спустя 30 мин. после приема NH4Cl в дозе 100 мг/кг. Из-за риска вызвать гепатоэнцефалопатию эту проверку следует проводить осторожно и только на тех собаках, у которых неврологическое расстройство минимально, а концентрация аммиака нормальная и устойчивая. Для собак проверка толерантности к азоту может быть также выполнена путем ректального введения 5%-ного NH4Cl.
Концентрация аммиака в крови не является диагностическим показателем гепатоэнцефалопатии у кошек, поскольку у этих животных отсутствует способность синтезировать аргинин, который участвует в детоксикации аммиака в печеночном цикле Кребса-Гесельстайна. Более того, у кошек с длительной анорексией иногда наблюдается повышенная концентрация аммиака в крови. Принудительный прием аммиака per os, проведенный на кошке с устойчиво высокой концентрацией аммиака в крови, может вызвать у животного гепатоэнцефалопатию, кому и даже привести к гибели животного.
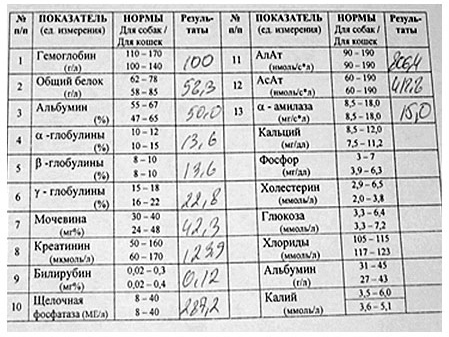
Концентрация сывороточных желчных кислот, измеренная натощак и спустя 2 часа после приема корма, считается безопасной и в равной степени достоверной проверкой для оценки функции клеток печени (см. Таблицу). Кроме того, никакой особой обработки образцов не требуется, поскольку сами они относительно стабильны. Концентрация желчных кислот в крови является очень полезным показателем для постановки диагноза гепатоэнцефалопатии у кошек.
Таблица. Общее содержание желчных кислот в сыворотке (нормальные значения для собак и кошек в мкмол/л)
| Натощак | Через 2 часа после приема корма | |
| Собака | 5 | 15-20 |
| Кошка | 4 | 10-15 |
По концентрации сывороточных желчных кислот нельзя дифференцировать болезни печени, однако, если их концентрация после приема корма сильно возрастает (более 150 ммол/л), то можно предполагать наличие цирроза или PSS. В большинстве лабораторий для определения концентрации желчных кислот в крови используют либо ферментный метод, с помощью которого измеряют общее содержание сывороточных 3альфа-гидроксилированных желчных кислот; либо радиоиммунный анализ (RIA), с помощью которого измеряют остатки специфических желчных кислот.
Рентгенография
Для всех случаев гепатоэнцефалопатии необходимо получить рентгеновские снимки брюшной полости. Печень у кошек и собак с гепатоэнцефалопатией может быть маленьких, увеличенных и даже нормальных размеров. Для идентификации как внутри, так и вне печеночного шунта, а также гепатопортальной микроваскулярной дисплазии можно использовать такие виды исследования, как спленопортографию, портографию через вену тощей кишки, портографию через краниальную брыжеечную артерию.
Наиболее предпочтительным является метод портографии через брыжеечную вену. После вентрального разреза по средней линии вокруг петли вены тощей кишки помещаются две лигатуры, катетер вставляется в сосуд и закрепляется.
Недопустимо использование металлической иглы.
Разрез брюшной полости временно закрывается. В катетер вводится соответствующее контрастное вещество, после чего проводится рентгеноскопия или рентгенография в латеральном и вентродорсальном направлениях. В качестве контраста используются омнипак 300 или 350 ,ультравист 370. Возможно использование урографина 70%, но нежелательно из-за возможных реакций на этот препарат у животных.
Доза омнипака для получения качественного изображения варьирует от 1 мл на кг веса у крупных собак до 2.5 мл на кг у мелких собак и кошек. Рентгеновский снимок делается в момент прохождения контрастного вещества через печень (этот момент обычно наступает к концу ведения препарата). Портография в ряде случаев имеет решающее диагностическое значение, помогает поставить правильный диагноз, оценить возможность дальнейшего лечения.
 |
 |
 |
| Слева — врожденный портокавальный шунт у собаки йоркширский терьер. В центре — Приобретенный портосистемный шунт у собаки при циррозе печени. Справа — Цирроз печени. |
||
Мульти-монолобулярный постнекротический активный цирроз печени.
Ультразвуковая эхография
Исследование с помощью ультразвука используется для идентификации внутрипеченочного шунта и для изучения системы печени и желчного пузыря, а также для исследования почек. В некоторых случаях наличия у собак внутрипеченочного шунта печень имеет малые размеры, вены печени очень малы или совсем неразличимы, а почечная лоханка увеличена. При правильном проведении ультразвуковая диагностика может дать решающие данные для правильного диагностирования гепатоэнцефалопатии.Ядерная сцинтиграфия печени представляет собой неинвазивный метод, пригодный для диагностики, однако его редко используют в повседневной практике.
Биопсия печени
Гистопатологические показатели, полученные из биопсии печени в случае гепатоэнцефалопатии, могут быть неявными. В некоторых случаях при врожденном портокавальном шунте наблюдается отсутствие ветви портальной вены на участке триады. Биопсию печени следует получать для того, чтобы можно было оценить другие проявления гепатопатии, такие как атрофия печени, диффузная жировая инфильтрация, цирроз, либо предциррозное состояние, фиброз, холангиогепатит и идиопатический липидоз у кошек. Иногда гистологическое или даже цитологическое исследование носит решающий характер в диагностике и прогнозе заболевания, так как дает наиболее обьективные данные о морфологии печени, помогает оценить возможности восстановления печени и выбрать правильное лечение.
Цитологическое исследование печени с липидозом
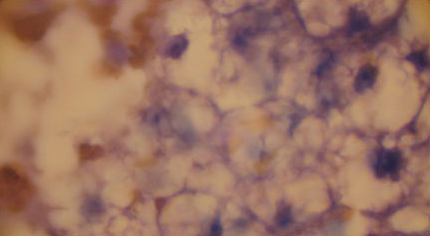 |
 |
 |
| Слева — Цитологическое исследование печени с липидозом. В центре — Цитологическое исследование печени с липидозом Справа — липидоз печени у кошки. |
||
Исследование мочи

Камень в мочевом пузыре у йоркширского терьера с портокавальным врожденным шунтом.
Исследование мочи при подозрении на гепатоэнцефалопатию является обязательным. Присутствие уратов в моче у молодого животного с высокой вероятностью говорит о наличии портокавального шунта и является показанием для проведения портографии. В моче определяются следующие показатели: билирубин, уробилиноген, гемоглобин, кальций, фосфор, микроскопия осадка.
Дифференциальные диагнозы
У молодых животных симптомы, подобные симптомам гепатоэнцефалопатии, могут появляться в случае идиопатической эпилепсии и при заболевании чумой гипокальциемии. Что касается более взрослых собак, то с гепатоэнцефалопатией можно спутать такие заболевания, как энцефалиты, гипогликемия, некоторые токсикозы, метаболические и эндокринные заболевания, уремию. Для того чтобы исключить дифференциальные диагнозы и определить природу нарушений, вызывающих гепатоэнцефалопатию, может оказаться необходимым использование в совокупности всех методов исследования.
Лечение
- Установить и устранить факторы, способствующие развитию гепатоэнцефолопатии.
- Предпринять меры, направленные на снижение и образование, и адсорбцию аммиака и других токсинов, образующихся в толстой кишке, включающих в себя модификацию пищевых белков, изменение кишечной микрофлоры и внутрикишечной среды.
Выбор методов лечения зависит от клинической картины, острой или хронической формы заболевания.
Методы лечения при острой гепатоэнцефолопатии:
- выявить факторы, способствующие возникновению гепатоэнцефолопатии;
- очистить кишечник от азотсодержащих веществ. (дать слабительное, сделать клизму);
- назначить безбелковую диету;
- назначить лактулозу; антибиотики (неомицин, метрогил);
- необходимо поддерживать калорийность пищи, должны быть приняты меры, направленные на восстановление жидкостного и электролитного баланса. Для этого проводят инфузионную терапию (с использованием препаратов гепасол, растворов Рингера, Хартмана.);
- Для лечения используются солкосерил, ноотропные препараты, глюкокортикоиды (метилпреднизолон), препараты, улучшающие реологические свойства крови (стабизол, рефортан).
Методы лечения при хронической энцефалопатии:
- ограничить содержание белка в корме;
- обеспечить опорожнение кишечника 2 раза в сутки
- Закислить содержимое кишечника, для того чтобы уловить аммиак (в виде NH4+) и ускорить его выведение из кишечника. Это достигается назначением лактулозы, которая также может быть использована в качестве безбелкового источника энергии для кишечных микроорганизмов, снижая, таким образом, дальнейшее производство аммиака. Стандартная доза составляет 2,5-5 мл для кошек и 2,5-15 мл для собак 3 раза в день. Недавно было показано, что многообещающие результаты в деле контролирования гепатоэнцефалопатии может обеспечить родственное лактулозе вещество — лактитол, которое принимают в виде порошка;
- при ухудшении состояния переходят на лечение, используемое при острой энцефалопатии.
Окклюзия шунтов
Хирургическое устранение портокавального шунта может привести к регрессу тяжелой портосистемной энцефалопатии. Данный метод лечения можно применять при врожденных и приобретенных портокавальных шунтах.
Лечение собак с гепатопортальной микроваскулярной дисплазией
Как такового специфического лечения при данной патологии не существует.
Прогнозы зависят от степени выраженности клинических симптомов. Первоначально таких больных переводят на кормление с наименее вредными источниками протеинов, растительные и молочные белки, добавляют лактулозу или лактитол.
Собакам со стойкими нейроповеденческими симптомами назначают антибиотики- неомицин, метронидазол. У собак с выраженными симптомами прогноз осторожный вплоть до неблагоприятного. У пациентов с гепатопортальной микроваскулярной дисплазией без симптомов возможен благоприятный прогноз вплоть до отличного. Тем не менее, рекомендуется пожизненное диетическое питание.
Холецистит
Холецистит – это воспаление желчного пузыря. Сопровождается нарушением работы желчевыводящей системы и выраженным застоем желчи. Статистически составляет 10-12% случаев среди заболеваний органов пищеварительной системы и чаще всего проявляется у лиц женского пола в возрасте после 40 лет.
Диагностикой и лечением этого заболевания занимается гастроэнтеролог.
Холецистит – что это за болезнь?
Если желчь длительное время лишена естественного оттока, она застаивается и воздействует на эпителий внутренних стенок, нарушая его барьерную функцию. В результате патогенные микроорганизмы легко проникают в полость органа, начинают активно размножаться и вырабатывать токсины, которые вызывают местное повышение уровня гистаминов. Возникает воспалительный процесс с отеком и болевым синдромом. Повышенная активность лейкоцитов в зоне поражения приводит к появлению гнойных и даже гангренозных изменений в тканях, которые в отсутствии лечения распространяются на более глубокие слои желчного пузыря и прилегающие органы.
Причины холецистита
Основная причина патологии – инфекционное поражение и нарушение оттока желчи. В роли патогенного возбудителя выступают стафилококк, стрептококк, кишечная палочка, вирусы гепатита, лямблии и даже круглые черви. Они проникают в область желчного пузыря через кровь и лимфу, провоцируя воспаление.
Нарушения желчного оттока могут вызвать:
- желчнокаменная болезнь (у взрослых сопровождает холецистит в 80-95% случаев);
- дискинезия желчевыводящих путей – ослабление эвакуаторной функции желчного пузыря;
- дислипидемии (нарушения жирового обмена);
- аномалии строения и различные новообразования, которые затрудняют дренаж желчи – кисты, опухоли, рубцы, сужения и искривления протоков;
- дисфункция клапанов;
- дисхолия – изменение состава желчи с увеличением ее вязкости;
- злоупотребление алкоголем и курением — провоцируют спазм и дискинезию ЖВП;
- гормональные изменения — снижают тонус гладкой мускулатуры.
Среди факторов воспаления отдельно стоит упомянуть аллергические реакции и хронические заболевания пищеварительной и эндокринной систем – диабет, гастрит, панкреатит. В частности, панкреатобилиарный рефлюкс – заброс ферментов поджелудочной железы в желчный пузырь – провоцирует развитие ферментативного холецистита.
Симптомы заболевания проявляются на фоне психологических нагрузок, неправильного питания, гиподинамии.
Внимание! В мегаполисах развитых стран диагноз «холецистит» имеет тенденцию к омоложению. Это вызвано нездоровым образом жизни и высоким уровнем постоянного стресса среди работающего населения.
Виды холецистита, их симптомы и признаки
Общий симптомокомплекс при холецистите представлен набором характерных синдромов:
- болевой – боль локализована в правом подреберье, может быть острого или ноющего характера;
- диспептический – тошнота, рвота, плотный налет на языке, отрыжка, метеоризм, нарушения стула;
- воспалительно-интоксикационный – повышение температуры от субфебрильной до 39 С, лихорадка, озноб, усиленное потоотделение;
- аллергический синдром в виде зуда и кожных высыпаний – характерен для паразитарных форм холецистита;
- астено-вегетативный – слабость, подавленность, раздражительность, бессонница;
- желтушный – механическая желтуха с изменением цвета кожных и слизистых покровов, глазных склер.
Упомянутые синдромы холецистита зависят от формы, типа и стадии заболевания.
Классификация холецистита
По активности проявления холецистит может быть:
- острый – с ярким течением и выраженной симптоматикой; характерна высокая интоксикация с приступообразным болевым синдромом;
- хронический – вялотекущий, с мягким проявлением симптомов (температура может отсутствовать, боль легкая, ноющая, тошнота не выражена, рвоты нет).
- калькулезный – с камнями в полости желчного пузыря; встречается в 90% случаев заболевания; часто провоцирует обострения с желтушным синдромом, коликами, интоксикацией;
- некалькулезный – бескаменный холецистит; объединяет примерно 10% случаев; характерен в основном для молодежи.
По проявлению патологического процесса:
- катаральный – легкое течение с благоприятным прогнозом;
- флегмонозный и гнойный – острый воспалительный процесс с высоким риском осложнений;
- гангренозный – выраженные деструктивные изменения с некрозом тканей;
- смешанный.
Внимание! Холецистит имеет сходную клиническую картину с аппендицитом, панкреатитом, язвенной болезнью, пиелонефритом и рядом других заболеваний, поэтому самостоятельная диагностика и лечение недопустимы и очень опасны!
Осложнения холецистита:
- холангит – воспаление желчных протоков;
- дуоденит – воспаление двенадцатиперстной кишки;
- реактивный гепатит;
- эмпиема желчного пузыря – скопление гноя в полости органа;
- лимфаденит – воспаление прилегающих лимфоузлов;
- разрыв пузыря;
- появление свищей и гангренозных участков;
- перитонит — воспаление брюшины.
Как проходит диагностика холецистита
Обследование включает визуальный осмотр со сбором анамнеза и вынесением предварительного диагноза, а также комплекс лабораторно-инструментальных методик для получения более полной картины состояния.
Лабораторные методики:
-
;
- общий анализ крови для выявления воспаления – уровень лейкоцитов и нейтрофилов, СОЭ; – уровень билирубина, щелочной фосфатазы, АСТ, АЛТ и др.;
- биохимическое исследование желчи – содержание белков, иммуноглобулинов, билирубина, пищеварительных ферментов;
- бакпосев желчи с определением инфекционного возбудителя;
- микроскопия желчи – проверяют наличие микролитов, кристаллов билирубина и холестерина, клеток эпителия и коричневых пленок, лейкоцитов, слизи;
- анализ на сахар, липидограмма, тест на уровень панкреатической амилазы выявляют сопутствующие заболевания – сахарный диабет, панкреатит, липидемии и пр.;
- иммуноферментный анализ (ИФА) на антитела к паразитам (лямблиям, гельминтам); .
Инструментальные методики используют для уточнения диагноза и в качестве вспомогательных мер при лабораторных исследованиях:
- УЗИ определяет размеры пузыря, наличие деформаций и конкрементов в протоках и полости; – для дифференциальной диагностики с инфарктом миокарда;
- эзофагогастродуоденоскопия – для исключения патологий в верхних отделах ЖКТ;
- холецистография (рентген желчного пузыря) и гепатобилисцинтиграфия (радиоизотопное исследование) выявляют мельчайшие конкременты и незначительные пороки желчевыводящих путей;
- КТ или МРТ с контрастом – выявляют изменения мягких тканей;
- панкреатохолангиография – для оценки состояния поджелудочной железы;
- дуоденальное зондирование – для забора пищеварительных соков, желчи.
Список методик может изменяться и дополняться. В тяжелых случаях, когда неинвазивные методы обследования не дают полной картины, используют лапароскопическую диагностику.
Лечение холецистита острой и хронической форм
Терапия заболевания имеет 4 основных направления:
- Устранение или ослабление симптомов;
- Воздействие на причину заболевания;
- Восстановительная терапия органа;
- Коррекция образа жизни для профилактики рецидивов.
В этих целях применяют медикаментозное лечение, физиотерапию, диетическое питание, хирургические методы лечения.
Важно! При острой форме заболевания в первые дни назначают щадящее голодание с внутривенным питанием организма. Это позволяет разгрузить гепатобилиарную систему.
Медикаментозная терапия включает следующие классы препаратов:
- антибиотики;
- спазмолитики;
- обезболивающие средства;
- НПВС для ликвидации воспалительного процесса;
- пищеварительные ферменты;
- желчегонные средства;
- пре- и пробиотики;
- прокинетики – для восстановления естественной эвакуаторной функции желчного пузыря и его протоков.
Препараты назначают в комплексе, с поправками на общее состояние пациента. Если диагностирован хронический холецистит, терапия антибиотиками проводится только в стадии обострения.
Физиотерапию используют при выходе из острой формы, в основном при лечении некалькулезной патологии. Назначают:
В период ремиссии большое внимание уделяют курортно-санаторному лечению с применением щелочных минеральных вод.
Хирургическое лечение панкреатита используют на стадии обострения при наличии выраженных деструктивных изменений или обширного гнойного процесса. Холецистостомию (дренирование) применяют для откачивания инфицированной желчи, чаще всего ее проводят методом лапароскопии. Холецистэктомию (удаление желчного пузыря) проводят открытым способом или с использованием лапароскопа.
Диетическое питание для каждого пациента разрабатывают индивидуально. Основой служит диета №5 по Певзнеру. Основные правила:
- Продукты перед употреблением измельчают.
- Из рациона удаляют раздражающие ингредиенты: острое, специи, соленья и маринады, растения с высоким содержанием эфирных масел (репа, редька, чеснок, мята, мелисса), чай, кофе, газировку.
- Избегают жареной пищи и животных жиров, включая жирные сорта мяса, сливочное масло, жирный творог и сливки, сало, копчености, ливер, колбасы; при калькулезном холецистите исключают яичные желтки и ограничивают количество растительных масел – их желчегонное действие может спровоцировать приступ колики.
- Стараются ограничить содержание бродильных продуктов – бобовых, капусты, свежих фруктов, сладостей.
Питание должно быть дробным, не менее 5-6 раз в день с потреблением большого количества чистой негазированной воды – 1,5-2 литра.
Источники:
- https://www.fdoctor.ru/bolezn/disfunktsiya_biliarnogo_trakta/
- https://zoostatus.ru/lechenie/bolezni/pechenochnaya-entsefalopatiya
- https://infovet.ru/lib/gepatologiya/kholetsistit-pervichnoe-zabolevanie-biliarnoy-sistemy/
- https://ivethelp.ru/sobaki/xolestaz-u-sobak/
- https://infovet.ru/lib/gepatologiya/pechenochnaya-entsefalopatiya-gepatoentsefalopatiya/
- https://polyclin.ru/articles/holecistit/
