От аллергий на укусы насекомых страдает каждый 10-ый житель нашей планеты. Пройти лечение реакции ребёнка или взрослого на укусы насекомых в Москве предлагает отделение аллергологии ЦЭЛТ.
Питание относится к жизнеобеспечивающей функции, поэтому к жалобам пациента на непереносимость каких-либо пищевых продуктов следует относиться максимально внимательно. Современная классификация непереносимости пищи включает следующие варианты. Исти
Гастроинтестинальные проявления пищевой аллергии у детей Рассмотрены атопические и эозинофильные заболевания пищеварительного тракта — гастроинтестинальная гиперчувствительность, оральный
Почему при ЖДА необходимы препараты железа? В чем преимущества препаратов последнего поколения? Почему прием препаратов железа должен быть длительным? Картина крови при хронической железодефицитной анемии. Выраженные гипохромия эритроци
Гастроинтестинальные проявления пищевой аллергии у детей
Рассмотрены атопические и эозинофильные заболевания пищеварительного тракта — гастроинтестинальная гиперчувствительность, оральный аллергический синдром, проктоколит и энтеропатия, индуцированные пищевыми белками, эозинофильный эзофагит и др.
The author analyses atopic and eosinophilic digestive system diseases – gastrointestinal hypersensitivity, oral allergic syndrome
Среди всех неблагоприятных реакций на пищу пищевая аллергия является одной из самых обсуждаемых проблем как среди педиатров, так и среди врачей-специалистов (аллергологов, нутрициологов, гастроэнтерологов). К сожалению, на сегодняшний день отсутствуют точные данные о распространенности пищевой аллергической реакции в мире. Это связано, с одной стороны, с многочисленными проявлениями заболевания, затрагивающими многие органы и системы, а с другой стороны — с трудностями точной верификации диагноза в клинической практике. Предположительно в мире насчитывается примерно 220–520 млн человек, страдающих пищевой аллергией [29].
Далеко не все неблагоприятные реакции на пищу относятся к пищевой аллергии. Исходя из общепринятого определения, к пищевой аллергии относят только иммунологически обусловленные реакции. К неблагоприятным реакциям на пищу относятся и целый ряд метаболических заболеваний, токсических реакций, непереносимость пищевых продуктов и т. д. (рис. 1).
![Рис. 1. Неблагоприятные реакции на пищу [30]](https://www.lvrach.ru/FileStorage/ARTICLE/Lechacshij_vrach/2012-02/01_12/13118836/Lechacshij_vrach_017-1_(7063).jpg)
Рис. 1. Неблагоприятные реакции на пищу [30]
К сожалению, существует как гипер-, так и гиподиагностика пищевой аллергии. По мнению большинства исследователей, именно 8 аллергенов вызывают подавляющее число аллергических реакций (рис. 2). По последним данным аллергия на коровье молоко (АБКМ) стабильно занимает второе место (после куриного яйца) как в Европе, так и в США и Японии. Жалобы родителей на аллергию к коровьему молоку колеблются в диапазоне от 1% до 17,5% у детей до 5 лет, от 1% до 13,5% у детей 5–16 лет и от 1% до 4% у взрослых [28, 29]. Пищевая аллергия чаще встречается у детей, чем у взрослых, и представляет собой серьезную глобальную проблему.
.jpg)
Рис. 2. Основные пищевые аллергены
Основные аллергены коровьего молока сосредоточены в сывороточной и казеиновой фракциях. К сывороточным аллергенам коровьего молока относятся: альфа-лактоальбумин (Bos d4), бета-лактоглобулин (Bos d5), бычий сывороточный альбумин (Bos d6), бычьи иммуноглобулины (Bos d7). Казеиновые аллергены (группа, известная как Bos d8) состоят из четырех разных белков (альфа1-, альфа2-, бета- и каппа-казеин). Чаще всего пациенты чувствительны к альфа- (100%) и каппа-казеинам (91,7%). Для практической работы важно помнить, что козье молоко очень близко по антигенному составу к коровьему молоку, поэтому перевод ребенка на козье молоко при наличии у него АБКМ неоправдан. Кроме того, аллергенами молока млекопитающих являются белки, поэтому назначение безлактозного молока детям, страдающим аллергией на коровье молоко, выглядит абсолютно абсурдным. Аллергены молока остаются биологически активны даже после кипячения, пастеризации, ультравысокотемпературной обработки и выпаривания. Получение гипоаллергенной смеси — это высокотехнологическая процедура, включающая в себя гидролиз с последующей термообработкой, ультрафильтрацией и применением высокого давления. В последнее время появились так называемые аминокислотные смеси, которые вообще не содержат белка, а в состав их входит необходимый набор аминокислот. Клинические проявления аллергии к белкам коровьего молока отличаются разнообразием и часто маскируются под хорошо известные проявления других заболеваний. Наиболее часто у детей с АБКМ обнаруживают кожные проявления (от 5% до 90%). Около 1/3 детей с атопическим дерматитом имеют молочную аллергию [30]. Острые реакции в виде анафилаксии встречаются значительно реже, но прогностически — это наиболее опасные проявления АБКМ. Поражения респираторного тракта проявляются и в виде аллергического ринита и в виде бронхиальной астмы при участии IgE-зависимых механизмов. Особой формой молочной аллергии является синдром Хейнера, или болезнь молочных преципитинов, обусловленная не-IgE-механизмами. Аллергическое поражение желудочно-кишечного тракта имеют по данным разных исследователей от 32% до 60% больных с молочной аллергией [30]. К сожалению, клинические проявления гастроинтестинального поражения у больных с АБКМ не всегда манифестны, что существенно затрудняют диагностику и, как следствие этого, адекватное лечение.
Существует целый спектр аллергических заболеваний пищеварительного тракта (табл. 1). Непосредственно к атопическим, т. е. IgE-опосредованным, относятся лишь немедленная гастроинтестинальная гиперчувствительность и оральный аллергический синдром. В основе белок-индуцированных энтеропатии и колита лежат клеточные реакции. Группировка этих заболеваний, исходя из ведущего иммунологического механизма, имеет практическое значение. Например, рrick-тесты (кожный тест-укол) и RAST (определение антител класса E) обладают высокой информативностью у пациентов с IgE-опосредованными заболеваниями и практически бесполезны при обследовании детей с заболеваниями, при которых ведущую роль играют клеточные механизмы. В отдельную группу выделяют эозинофильные заболевания пищеварительного тракта. В их патогенезе участвуют как IgE-зависимые, так и клеточные механизмы, где ключевое значение имеют эозинофилы. Морфологическими особенностями, характерными для этой группы заболеваний, являются преобладание в воспалительном инфильтрате эозинофилов, их группировка (эозинофильные микроабсцессы), внедрение в эпителий и дегрануляция.
Эозинофилы функционируют как антиген-презентирующие клетки, а также индуцируют воспалительный процесс при участии специальных белков — EDGP (Eosinophil-Derived Granule Proteins). В их состав входят катионные белки эозинофилов (ECP), эозинофильный нейротоксин (EDN), пероксидаза эозинофилов (EPO) и так называемый major basic protein (MBP). Эти белки обладают цитотоксическим эффектом на эпителий пищеварительного тракта, а также вызывают дегрануляцию тучных клеток с высвобождением цитокинов (IL-1, IL-3, IL-4, IL-5, IL-13, трансформирующий фактор роста), хемокинов (эотоксин) и нейромедиаторов (субстанция P, вазоактивный интестинальный полипептид) [1, 2].
Немедленная гастроинтестинальная гиперчувствительность
Немедленная гастроинтестинальная гиперчувствительность (НГГ) — это IgЕ-опосредованное заболевание, характеризующиеся появлением тошноты, рвоты и боли в животе спустя несколько минут/1–2 часа после употребления «причинных» продуктов. Диарея может присоединяться через 2–6 часов [3].
Часто симптомы со стороны желудочно-кишечного тракта сочетаются с реакциями гиперчувствительности I типа со стороны кожи, глаз, дыхательной системы, а также анафилактической реакцией. Однако гастроинтестинальные симптомы могут быть единственным проявлением пищевой аллергии даже у тех пациентов, у которых те же аллергены вызывают IgE-опосредованные реакции со стороны других органов и систем. Например, у ребенка с атопическим дерматитом, обусловленным сенсибилизацией к пищевому аллергену (и наличием специфических IgE) употребление «причинного» продукта может вызвать только проявления НГГ без каких-либо симптомов со стороны кожи [4].
Чаще всего НГГ вызывают молоко, яйца, арахис, соя, пшеница и морепродукты. Как и при других IgE-опосредованных заболеваниях, аллергия к молоку, яйцам, пшенице и сое с возрастом, как правило, проходит. Непереносимость арахиса, лесных орехов и морепродуктов может сохраняться в течение всей жизни.
В диагностике наряду с анамнестическими данными выявляют повышенный уровень специфических IgE и положительные кожные prick-тесты.
Оральный аллергический синдром
Оральный аллергический синдром (ОАС) — это IgЕ-опосредованное заболевание, характеризующееся появлением покраснения, зуда, жжения в ротовой полости, а также отеком губ, языка и неба [3]. Симптомы развиваются сразу после употребления некоторых свежих фруктов и овощей. Нередко дети отказываются есть «причинные» продукты. В 1–2% случаев могут развиваться тяжелые аллергические реакции [5]. ОАС дебютирует, как правило, после года (в дошкольном возрасте) и ассоциируется с сезонным аллергическим ринитом и/или конъюнктивитом. Дебюту этого синдрома почти всегда предшествует сенсибилизация пыльцой, содержащей белки, гомологичные тем, что находятся в определенных фруктах и овощах. При этом пациент, сенсибилизированный к пыльце, может реагировать на пищевой аллерген без предшествовавшего с ним контакта. Например, сенсибилизация к пыльце амброзии полыннолистной может сочетаться с ОАС после употребления дыни, а сенсибилизация к пыльце березы может приводить к появлению этого синдрома после употребления яблок, персиков и вишни. Кроме того, могут быть перекрестные реакции между латексом и бананом, авокадо, персиком, киви, абрикосом, грейпфрутом, маракуйей, ананасом, каштаном. Белки, индуцирующие ОАС, термолабильны, поэтому употребление фруктов и овощей, прошедших кулинарную обработку, не приводит к появлению симптомов. Диагностика ОАС базируется на типичном анамнезе и на основании результатов prick-тестов и IgE в сыворотке крови.
Проктоколит, индуцированный пищевыми белками
Проктоколит, индуцированный пищевыми белками (ПИПБ), — не-IgE-опосредованное заболевание, вызванное иммунным ответом против пищевых белков, характеризующееся наличием слизи и/или крови в стуле у внешне здорового младенца. Обычно заболевание дебютирует в течение первых 6 месяцев (в среднем в 2 месяца), хотя манифестировать болезнь может с первых дней жизни [6].
В 60% случаев ПИПБ встречается у детей, находящихся на естественном вскармливании. В этом случае иммунный ответ направлен на продукты, входящие в рацион матери. Чаще всего аллергическая реакция развивается на белки коровьего молока и сои. Несколько реже на яйца, орехи, арахис и морепродукты. У детей, находящихся на искусственном вскармливании, реакция, как правило, развивается на белки коровьего молока и сои, входящие в состав смесей [7].
ПИПБ является наиболее частой причиной ректального кровотечения у грудных детей. Появление крови в стуле связано с повышенной ранимостью воспаленной слизистой толстой кишки, а в ряде случаев с наличием эрозий [8]. Кровь может быть смешана со слизью или быть в виде вкраплений и прожилок (что часто ошибочно расценивают как проявление перианальных трещин). Кровопотеря, как правило, минимальна и не ведет к развитию гематологических изменений.
Слизь в кале (в виде прожилок или тяжей) может быть единственным проявлением ПИПБ (кровь макроскопически может не определяться). При микроскопии в слизи обнаруживают повышенное количество лейкоцитов, значительная часть которых представлена эозинофилами.
Иногда основные симптомы ПИПБ ассоциируются с кишечной коликой и увеличением частоты опорожнения кишечника. Важно помнить, что несмотря на наличие таких серьезных симптомов, как слизь и кровь в стуле, дети практически всегда выглядят здоровыми и хорошо прибавляют в весе. Это следует учитывать в дифференциальной диагностике ПИПБ с другими заболеваниями (например, кишечными инфекциями, воспалительными заболеваниями кишечника), при которых, как правило, наряду с симптомами гемоколита имеют место тяжелое состояние ребенка, обезвоживание, плохие весовые прибавки или похудание, а также выраженные гематологические изменения.
Необходимо иметь в виду, что у детей с ПИПБ маркеры атопии (атопический дерматит, отягощенный аллергический семейный анамнез, повышение уровня эозинофилов в крови) встречаются не намного чаще, чем в обычной популяции [7]. Редко можно обнаружить повышение титра общего и специфических IgE, а также положительные кожные prick-тесты. Это объясняется не-IgE-зависимым механизмом развития данного заболевания [3].
_550.jpg)
Рис. 3. Эндоскопические изменения при ПИПБ
Для диагностических целей эндоскопическое исследование обычно не требуется, но в тех случаях, когда его проводят, обнаруживают эритему, контактную ранимость, ослабление сосудистого рисунка и лимфонодулярную гиперплазию. В тяжелых случаях обнаружают эрозии. Изменения, как правило, локализуются в прямой кишке, но иногда захватывают всю толстую кишку [9] (рис. 3). При гистологическом исследовании обнаруживают увеличенное число эозинофилов в собственной пластинке слизистой оболочки (> 6 эозинофилов ×400). В тяжелых случаях наблюдают внедрение эозинофилов в эпителий крипт (эозинофильный криптит), скопления эозинофилов (эозинофильные микроабсцессы) и наличие нейтрофилов (активное воспаление) [10] (рис. 4). Несмотря на сообщения о периферической эозинофилии и выявлении IgE-специфических антител, они обнаруживаются редко [3].
Лечение ПИПБ заключается в элиминации аллергена из рациона кормящей матери (если ребенок находится на естественном вскармливании) или переводе на смеси с глубоким гидролизом белков (если ребенок получает смесь на основе коровьего молока или сои). Однако в 10% случаев развитие ПИПБ возможно у детей, получающих смеси на основе глубокогидролизованных белков коровьего молока. В этой ситуации ребенка переводят на аминокислотные смеси, что ведет к полному исчезновению симптомов [6].
Рис. 4. Гистологические изменения при ПИПБ
Энтеропатия, индуцированная пищевыми белками
Энтеропатия, индуцированная пищевыми белками (ЭИПБ), характеризуется хронической диареей, рвотой, мальабсорбцией и плохой прибавкой в весе. Дополнительными признаками могут быть: вздутие живота, чувство быстрого насыщения и перианальный дерматит. В тяжелых случаях может развиться белоктеряющая энтеропатия, которая сопровождается гипопротеинемией и отеками.
Чаще всего заболевание развивается у детей первых месяцев жизни, находящихся на искусственном вскармливании, в результате иммунной реакции на белки коровьего молока или сои. Реже ЭИПБ может быть вызвана злаками, овсом, яйцами, рисом, рыбой и морепродуктами. В этих случаях заболевание дебютирует в зависимости от сроков введения «причинных» продуктов [6].
ЭИПБ может дебютировать после острого вирусного гастроэнтерита. Это может быть связано как с реализацией «замаскированной» гиперчувствительности, так и с патологической иммунной реакцией слизистой кишечника в ответ на поступление антигенов в период повышенной проницаемости кишечного барьера [11].
Нередко ЭИПБ развивается у детей, находящихся на естественном вскармливании. При этом симптомы могут появиться даже в течение первых 2 недель жизни [12]. У таких пациентов может быть реакция одновременно на многие продукты, входящие в рацион кормящей матери. В этой группе низкие прибавки в массе отмечаются примерно в 25% случаев, причем нередко с рождения [13].
Несмотря на то, что ЭИПБ относится к не-IgE-опосредованным заболеваниям, у этих пациентов могут быть сопутствующие состояния, обусловленные немедленными аллергическими реакциями. В частности, отягощенная наследственность, высокий уровень общего IgE, положительные prick-тесты, а также экзема, крапивница, ангионевротический отек и анафилактические реакции в анамнезе. Сочетание симптомов поражения пищеварительного тракта с симптомами гиперчувствительности немедленного типа позволяют врачу подумать об этом заболевании.
Гораздо сложнее заподозрить ЭИПБ в тех случаях, когда симптомы со стороны пищеварительного тракта не ассоциируют с отягощенной наследственностью и очевидными аллергическими реакциями на пищу. Общий IgE может быть нормальным, а специфические IgE и кожные тесты отрицательными. Редко думают об ЭИПБ при отсутствии одного из основных симптомов этого заболевания — низкой прибавке в массе тела. В этом случае на первый план выходят симптомы нарушения моторики: гастроэзофагеальный рефлюкс, кишечная колика, раздражительность [14].
Для диагностики необходимо сделать эндоскопию и гистологическое исследование. Наиболее характерным эндоскопическим признаком ЭИПБ является лимфонодулярная гиперплазия (симптом «булыжной мостовой») (рис. 5). При гистологическом исследовании обнаруживают атрофию, мононуклеарную инфильтрацию собственной пластинки слизистой тонкой кишки в сочетании с увеличением числа интраэпителиальных лимфоцитов [6]. Эти изменения очень напоминают целиакию. Но при ЭИПБ не повышается титр антител к тканевой трансглютаминазе и эндомизию и реже обнаруживают HLA-маркеры глютеновой энтеропатии (DQ2 и DQ8) [15]. В отличие от целиакии, ЭИПБ, как правило, проходит через 1–2 года и повышает риск малигнизации.
.jpg)
Рис. 5. Энтеропатия, индуцированная пищевыми белками
Окончательный диагноз устанавливают с помощью элиминационной диеты и провокационного теста.
АБКМ — одна из наиболее распространенных причин энтероколитического синдрома (FPIES), формы не-IgE-опосредованной аллергии, которая развивается в течение 1–3 часов после введения молочного белка. FPIES проявляется следующими симптомами: повторяющейся рвотой, гипотонией, бледностью, иногда — гипотензией и диареей. FPIES часто проявляется с первым введением коровьего молока в рацион, но не зафиксирован у детей на грудном вскармливании. Ремиссия обычно развивается в течение первых нескольких лет жизни. Вызванный коровьим молоком энтеропатический синдром — редкая болезнь, обычно проявляется диареей, потерей в весе, различными степенями рвоты, периодической гипопротеинемией и стулом с кровью. Хотя многие дети с этой болезнью положительно отвечают на высокогидролизные смеси, основанные на коровьем молоке, некоторым для достижения ремиссии заболевания необходим перевод на аминокислотные смеси.
Эозинофильный эзофагит
Эозинофильный эзофагит (ЭЭ) — заболевание, характеризующееся изолированной выраженной эозинофильной инфильтрацией пищевода и манифестирующее рефлюкс-подобными симптомами (отрыжка, боль в эпигастрии или за грудиной, рвота, изжога, трудности кормления и дисфагия), не отвечающими на антисекреторную терапию. ЭЭ встречается в любом возрасте и может осложняться стриктурами пищевода, образованием колец Schatzki и ахалазией. Эти осложнения связаны с тем, что эозинофильное воспаление может приводить к развитию фиброза и ремоделированию пищевода [16].
Распространенность ЭЭ точно не определена и колеблется в пределах от 1 до 9 на 100 000 населения. По данным детского госпиталя в Питсбурге (США), обслуживающего примерно 1 миллион детей, ежегодно диагностируется около 100 новых случаев ЭЭ. Мальчики болеют чаще девочек. Заболевание чаще встречается среди школьников и молодых взрослых [17].
Примерно у 50% детей отмечаются проявления аллергии со стороны других органов и систем: бронхоспазм, аллергический ринит, экзема. У 35% больных с этим заболеванием отягощен аллергологический анамнез, а у 50–80% имеются атопические заболевания [18].
У детей младшего возраста в клинической картине ЭЭ доминируют рефлюкс-подобные симптомы и трудности при кормлении (отказ от еды, избегание пищи определенной консистенции).
У подростков и взрослых ЭЭ чаще всего проявляется симптомами дисфагии и/или эпизодами застревания пищи в пищеводе. Эти явления могут быть вызваны как преходящим спазмом гладкой мускулатуры пищевода, так и ремоделированием пищевода (стриктуры, кольца), обусловленным хроническим эозинофильным воспалением [19].
Ключевую роль в диагностике играют эндоскопия и гистология. Однако в план обследования необходимо включить и рентгенологическое исследование с барием, позволяющее исключить аномалии развития пищевода, стриктуры и кольца Schatzki (которые могут быть пропущены при эндоскопическом исследовании).
_550.jpg)
Рис. 6. Эозинофильный эзофагит: эндоскопическая картина
ЭЭ может быть заподозрен при обнаружении следующих эндоскопических признаков (рис. 6):
- Воспалительные изменения одинаково выражены как в дистальной, так и в средней части пищевода (в отличие от рефлюкс-эзофагита, при котором наибольшие изменения находят в дистальном отделе).
- Линейные вертикальные борозды.
- Циркулярные складки («кольца»).
- Налет на слизистой в виде белых «крупинок» (≈1 мм в диаметре).
- Контактная кровоточивость [19].
Биоптаты следует брать как из дистальной, так и из средней трети пищевода (где при ЭЭ обнаруживают наибольшее число эозинофилов). В связи с тем, что патологические изменения могут иметь «пятнистый» характер, необходимо брать не менее 5 биоптатов [20]. Диагноз «эозинофильный эзофагит» не может быть поставлен без проведения гистологического исследования. В норме слизистая оболочка пищевода у детей не содержит эозинофилов. При гастроэзофагеальном рефлюксе обнаруживают в среднем 1–5 интраэпителиальных эозинофила в поле зрения (при увеличении ×400) [20]. В случае тяжелого рефлюкс-эзофагита число интраэпителиальных эозинофилов может достигать 10–15 в поле зрения (×400) (рис. 7).
_550.jpg)
Рис. 7. Эозинофильный эзофагит: гистология
При ЭЭ обнаруживают более 15 интраэпителиальных эозинофилов, а в тяжелых случаях их число может достигать 45 и даже 100 клеток в поле зрения (×400). Для ЭЭ характерно поверхностное расположение эозинофилов, образование их скоплений (микроабсцессы — белые «крупинки», определяемые при эндоскопии) и дегрануляция [20].
Следует иметь в виду, что эозинофильная инфильтрация слизистой оболочки пищевода может встречаться не только при рефлюксной болезни и эозинофильном эзофагите, а также при болезни Крона, целиакии и васкулитах.
Подумать об ЭЭ необходимо в тех случаях, когда у пациента с симптомами рефлюкса и/или дисфагией эмпирическая антисекреторная терапия неэффективна. Особенно если это наблюдается у пациента с аллергическим заболеванием.
Окончательно ЭЭ подтверждается повторной эндоскопией с биопсией после лечения.
Лечение ЭЭ включает элиминационную диету и фармакотерапию, направленную на подавление эозинофильного воспаления (табл. 2).
В нетяжелых случаях элиминационная диета может быть использована как монотерапия. Те или иные продукты могут быть исключены из рациона как на основании аллергообследования, так и эмпирически. Поскольку ЭЭ не является «чистым» IgE-зависимым заболеванием, то, к сожалению, полагаться на результаты аллергопроб на 100% нельзя. В последние годы используют эмпирическую элиминационную диету с исключением 6 продуктов: молока, сои, яиц, пшеницы, арахиса и морепродуктов. Эффективность этого подхода превышает 80% [21]. Альтернативой является использование смесей на основе аминокислот. Иногда, учитывая вкусовые пристрастия пациентов, в смеси добавляют фруктовые соки [19]. Клинически улучшение наступает, в среднем, через 8 дней, а нормализация гистологической картины через 4 недели [22].
В тяжелых случаях, наряду с элиминационной диетой, используют противовоспалительные препараты. Системные стероиды (преднизолон, метилпреднизолон) эффективно подавляют воспаление и купируют симптомы. Однако их применение ограничено в связи с побочными эффектами и 90% вероятностью рецидива после отмены. Местное лечение стероидами (флютиказон и будесонид) эффективно в 80% случаев и не сопряжено с системными побочными эффектами. Флютиказон вводят через рот с помощью дозированного ингалятора (без спейсера). Аэрозоль, не вдыхая, распыляют в ротовую полость. Лекарство попадает в пищевод со слюной, оказывая местный противовоспалительный эффект. Вязкую суспензию будесонида готовят, используя содержимое небул. Наиболее частым побочным эффектом местного лечения стероидами является кандидоз пищевода, который встречается у 10–15% пациентов.
Монтелукаст обладает неплохим симптоматическим эффектом, однако не уменьшает эозинофильную инфильтрацию в пищеводе, что, теоретически, сохраняет вероятность ремоделирования пищевода. В настоящее время идут II и III фазы клинических испытаний препаратов на основе моноклональных антител к IgE (омализумаб) и IL-5 (реслизумаб, меполизумаб). Несмотря на обнадеживающие предварительные результаты, омализумаб, при хорошем симптоматическом эффекте, не снижает эозинофильную инфильтрацию, а реслизумаб и меполизумаб хоть и снижают тканевую эозинофилию, не устраняют симптомы [23].
Эозинофильный гастрит, гастроэнтерит, гастроэнтероколит (ЭГ)
ЭГ входят в семейство эозинофильных заболеваний желудочно-кишечного тракта. В отличие от ЭЭ эозинофильная инфильтрация редко ограничивается одним органом (только желудком или только тонкой кишкой). Обычно эозинофильное воспаление захватывает сразу несколько отделов пищеварительной трубки. Чаще одновременно поражается желудок и тонкая кишка (эозинофильный гастроэнтерит). Клиническая картина зависит от того, какой слой пищеварительной трубки инфильтрирован эозинофилами. Если в патологический процесс вовлечена только слизистая оболочка, то доминируют боль в животе, тошнота, рвота и диарея. Если эозинофилы сосредоточены в мышечном слое, то на первый план выходят симптомы непроходимости (тошнота, рвота, вздутие живота). В том случае, если эозинофилы сконцентрированы в субсерозном слое, то заболевание проявляется асцитом, а в асцитической жидкости обнаруживают большое число эозинофилов [17].
Эндоскопическое исследование с биопсией информативны только при поражении слизистой оболочки. Макроскопически обнаруживают эритему, эрозии, нодулярность или полипоидные разрастания в антруме и/или тонкой кишке. При гистологическом исследовании в воспалительном инфильтрате доминируют эозинофилы, количество которых превышает 20 клеток в поле зрения (×400). В связи с тем, что патологические изменения носят фокальный характер, необходимо брать не менее 5 биоптатов из каждого отдела пищеварительной трубки, причем биопсию следует делать как из измененных, так и из внешне нормальных участков [24].
Если эозинофилы инфильтрируют мышечный или субсерозный слои, то диагноз может быть установлен при гистологическом исследовании биоптатов, полученных интраоперационно, а также при цитологическом анализе асцитической жидкости.
При ЭГ наиболее эффективно лечение системными стероидами (20–40 мг в сутки), которые дают четкий положительный эффект уже через 1–2 недели. В одних случаях удается быстро снизить дозу (в течение 2 недель) и прекратить прием препарата. В других случаях пациенты вынуждены получать длительно поддерживающие дозы (5–10 мг/сут).
Как и при ЭЭ, неплохую эффективность показала эмпирическая элиминационная диета. Сообщалось об удовлетворительных результатах применения Кетотифена и Кромолина [26, 27].
Диета детей с гастроинтестинальными проявлениями пищевой аллергии
Необходимым методом лечения детей с аллергическими реакциями следует считать полную элиминацию причинного аллергена. Именно частичная элиминация аллергена (сознательная или случайная) является самой частой причиной безуспешного лечения детей с пищевой аллергией. Конечно, установление причинно-значимого аллергена — это очень трудная задача, но абсолютно необходимая. Современный алгоритм диагностики спектра причинных аллергенов включает в себя анализ клинической картины заболевания, оценку дополнительных методов исследования (рrick-тесты и уровня специфических IgE), эффекта элиминации и проведения провокационных тестов. В случае не-IgE-зависимых иммунных реакций отсутствуют общепризнанные методы лабораторной диагностики причинных аллергенов. При доказанной причинности выявленного аллергена следует устранить его в диете пациента на срок, зависящий от очень многих факторов. Одной из часто встречающихся ошибок при появлении признаков пищевой аллергии является перевод ребенка с естественного вскармливания на искусственное с использованием смесей с высокой степенью гидролиза. Такую практику следует признать как недопустимую. В настоящее время отсутствуют убедительные данные в пользу этого метода лечения пищевой аллергии. Следует назначить элиминационную диету матери с исключением всех причинных продуктов. Именно естественное вскармливание является оптимальным при пищевой аллергии у детей. Необходимо продумать способы, позволяющие избежать случайный прием, вдыхание или контакт с провоцирующей пищей. Врач должен также предупредить пациента о возможности перекрестных реакций (например, с молоком буйвола, козы, овцы), обеспечить полноценную диету матери и настроить ее на обязательное соблюдение диеты путем полного информирования и разъяснения необходимости данных лечебных мероприятий. Если ребенок находится на искусственном вскармливании, то необходимо перевести ребенка на аминокислотную смесь или на смесь с высокой степенью гидролиза белка. Любая попытка перевода ребенка на соевую смесь или гипоаллергенную молочную смесь следует трактовать как ошибку. Смеси на основе гидролиза сывороточных молочных белков — Nutrilon ® Пепти Аллергия, Nutrilon® Пепти ТСЦ, Фрисопеп, Альфаре. Смеси на основе гидролиза казеина — Нутрамиген, Прегестимил, Фрисопеп АС. Молочные смеси с 40% гидролизом белка (Hipp HA 1, Hipp HA 2, Humana 0-HA, Humana HA 1, Humana HA 2) используются только для профилактики у детей, у которых существует угроза формирования пищевой аллергии.
Nutrilon ® Пепти Аллергия с пребиотиками — специально разработанная смесь для питания детей, страдающих АБКМ. Она производится в соответствии с директивой FSMP 1999/21 ЕС Евросоюза в отношении лечебного питания [33] и отвечает рекомендациям ESPGHAN/ESPACI [31] и ААР [32] по лечению детей, страдающих АБКМ. Nutrilon® Пепти Аллергия применяется у детей с рождения. Белковый компонент в Nutrilon ® Пепти Аллергия представлен глубокогидролизованным сывороточным белком, при этом на долю свободных аминокислот приходится 15–20%, а на долю короткоцепочечных пептидов — 80–85%. Сывороточный белок обладает лучшим аминокислотным профилем по сравнению с казеином и значительно лучшими вкусовыми качествами. Nutrilon ® Пепти Аллергия содержит приблизительно на 50–60% меньше лактозы по сравнению с обычными смесями. Это качество смеси имеет особое значение у детей с гастроинтестинальными проявлениями пищевой аллергии, так как поражение слизистой оболочки желудочно-кишечного тракта, в частности тонкой кишки, приводит к снижению активности лактазы. Наличие в смеси комплекса пребиотиков Immunofortis способствует формированию пищевой толерантности, что доказано в ряде клинических исследований [34, 35].
Белковый компонент Nutrilon ® Пепти ТЦС представлен глубокогидролизованным сывороточным белком, что и в Nutrilon ® Пепти Аллергия. Nutrilon® Пепти ТЦС применяется у детей с синдромом мальабсорбции, нарушением всасывания жиров, воспалительными заболеваниями кишечника (болезни Крона и неспецифическом язвенном колите), множественной пищевой аллергии. Для облегчения всасывания жировой компонент в Nutrilon ® Пепти ТЦС на 50% замещен среднецепочечными триглицеридами, что особенно важно для детей с мальабсорбцией. Nutrilon ® Пепти ТЦС также содержит длинноцепочечные полиненасыщенные жирные кислоты (докозагексаеновую и арахидоновую) и обогащена нуклеотидами, играющими важную роль в регенерации поврежденных клеток кишечника.
Аминокислотные смеси и гидролизные смеси абсолютно безопасны и могут длительно использоваться в качестве заменителя коровьего молока у больных с АБКМ.
Следующей, довольно часто встречающейся ошибкой среди практикующих врачей является перевод ребенка на соевую смесь в случае выявления АБКМ. В настоящее время убедительно доказано, что в детской популяции отмечается высокая частота сенсибилизации к соевым продуктам. Кроме того, соевые смеси не предотвращают формирование сенсибилизации к аллергенам коровьего молока [36]. Соевые смеси не рекомендованы в лечении детей с АБКМ до 6 месяцев в США [37]. Соевые смеси должны быть ограничены к использованию не только за счет перекрестной сенсибилизации, но и за счет присутствия в них изофлавонов, которые могут оказать нежелательное воздействие [38, 39]. Попытка решения этой проблемы привела к созданию соевых гидролизных смесей и рисовых гидролизных смесей. Эти смеси обладают всеми преимуществами, характеризующими высокогидролизные смеси, и не содержат даже следов молочных белков. Рост, развитие, биохимические параметры сыворотки крови и толерантность к смесям у здоровых детей при кормлении экспериментальной частично гидролизной смесью на основе риса и на основе белков коровьего молока были нормальные [29]. В нашей стране эти смеси еще не зарегистрированы и не представлены на рынке лечебного питания, хотя во многих странах Европы и США активно используются.
К сожалению, и переход на молочную смесь с высокой степенью гидролиза может не привести к исчезновению симптомов АБКМ, так как и на них возможно развитие аллергической реакции. Поэтому «золотым стандартом» лечения и диагностики детей с АБКМ является перевод их на элементную смесь на основе аминокислот (Nutrilon ® Аминокислоты и Неокейт). Аминокислотные смеси произведены на основе аминокислот, без применения белка, не запускают и не поддерживают аллергическую реакцию. Аминокислотные смеси хорошо переносятся, и дети легко переходят на элементную смесь, так как она лишена горького привкуса, характерного для всех смесей с высокой степенью гидролиза белка. Nutrilon ® Аминокислоты — адаптированная смесь и может быть использована как на короткий период диагностики АБКМ, так и в качестве основной смеси для длительного вскармливания. Nutrilon ® Аминокислоты создана для полноценного вскармливания детей первого года жизни, находящихся на безмолочной элиминационной диете. Nutrilon ® Аминокислоты не содержит белок, лактозу и глютен. Состав полностью адаптирован и рассчитан на длительное вскармливание. Nutrilon ® Аминокислоты — элементное питание, и при наличии IgE-опосредованных реакций не требуется постепенного перехода с предыдущей формулы. Постепенный переход удлиняет период сенсибилизации организма ребенка. В случае IgE-независимых реакций рекомендуется постепенное введение смеси в течение 5 дней.
Показания к назначению аминокислотных смесей [40]
• Тяжелое течение аллергии (при наличии одного и более критериев):
- гастроинтестинальные симптомы;
- дерматологические симптомы;
- респираторные симптомы;
- системные реакции — анафилаксия.
• При неэффективности диетотерапии смесями на основе высокогидролизованного белка (2–4 недели применения).
• При легком и среднетяжелом течении аллергии:
- при плохой переносимости смесей на основе высокогидролизованного белка (горький вкус, отказ от приема пищи);
- мнение специалиста (соотношение цена/эффективность, наличие в льготе).
• Диагностика пищевой аллергии/аллергии к белкам коровьего молока в ситуациях, когда недоступно обычное аллерготестирование или результаты обследования могут быть противоречивы.
Абсолютным показанием для перевода ребенка на аминокислотную смесь являются анафилактические реакции на белок коровьего молока, поражения желудочно-кишечного тракта (гастроэзофагеальная рефлюксная болезнь) и синдром Хейнера. При назначении аминокислотной смеси желудочно-кишечные симптомы проходят в течение 1–3 дней [41]. Другие симптомы постепенно ослабевают и окончательно исчезают к 14-му дню [42]. Прием аминокислотной смеси приводит к значимому улучшению клинических симптомов атопического дерматита [43]. При назначении аминокислотных смесей симптомы со стороны желудочно-кишечного тракта исчезают значительно быстрее, чем при использовании гидролизных смесей [44]. При использовании аминокислотной смеси рост и прибавки веса детей значимо выше, чем при использовании смесей на основе гидролизных белков [43, 44]. Аминокислотная смесь должна использоваться для диагностики аллергии на гидролизные смеси. При аллергии на гидролизные смеси использование смеси на основе аминокислот обеспечивает безопасную альтернативу [44].
Лечение детей, страдающих гастроинтестинальными проявлениями пищевой аллергии, представляет собой сложную проблему. Отсутствие клинических проявлений заболевания, непосредственно связанных с приемом продукта, наличие не-IgE-зависимых механизмов формирования заболевания, затрудняющих лабораторное подтверждение сенсибилизации, желание лечащего врача трактовать появления симптомов поражения желудочно-кишечного тракта как сопутствующее заболевание — все это создает проблемы адекватной и своевременной диагностики и лечения аллергических поражений пищеварительного тракта.
- Rankin S. M., Conroy D. M., Williams T. J. Eotaxin and eosinophil recruitment: Implication for human disease // Mol Med Today. 2000, 6: 20.
- Hogan S. P., Rothenberg M. E., Forbes E. et al. Chemokines in eosinophil-associated gastrointestinal disorders // Curr Allergy Asthma Rep. 2004, 4: 74.
- Sicherer S. H. Clinical aspects of gastrointestinal allergy in childhood // Pediatrics. 2003; 111: 1609–1616.
- Burks A. W., James J. M., Hiegel A. et al. Atopic dermatitis and food hypersensitivity reactions // J Pediatr. 1998. 132: 132–136.
- Ortolani C., Pastorello E. A., Farioli L. et al. IgE-mediated allergy from vegetable allergens // Ann Allergy. 1993; 71: 470–476.
- Lake A. M. Food protein-induced proctitis/colitis, enteropathy, and enterocolitis of infancy. UpToDate, September 2011.
- Lake A. M., Whitington P. F., Hamilton S. R. Dietary protein induced colitis in breast-fed infants // J Pediatr. 1982; 101: 906–910.
- Jenkins H. R., Pincott J. R., Soothill J. F. et al. Food allergy: the major cause of infantile colitis // Arch Dis Child. 1984; 59: 326–329.
- Jin-Bok Hwang, Moon Ho Park, Yu Na Kang et al. Advanced Criteria for Clinicopathological Diagnosis of Food Protein-induced Proctocolitis // J Korean Med Sci. 2007; 22: 213–217.
- Winter H. S., Antonioli D. A., Fukagawa N. et al. Allergy-related proctocolitis in infants: diagnostic usefulness of rectal biopsy // Mod Pathol. 1990; 3: 5–10.
- Leinman R. E. Milk protein enteropathy after acute infectious gastroenteritis: experimental and clinical observations // J Pediatr. 1991; 118: S111–S115.
- Iyngkaran N., Yadav M., Boey C. et al. Severity and extent of upper small bowel mucosal damage in cow’s milk protein-sensitive enteropathy // J Pediatr Gastroenterol and Nutr. 1988; 8: 667–674.
- Heine R. G., Elsayed S., Hill D. J. Cow’s milk allergy in infancy // Curr Opin Allergy Clin Immunol. 2002; 2: 217–225.
- Latcham F., Merino F., Lang A. et al. A consistent pattern of minor immunodeficiency and subtle enteropathy in children with multiple food allergy // J Pediatr. 2003; 143: 39–47.
- Sampson H. A., Anderson J. A. Summary and Recommendations: Classification of Gastrointestinal Manifestations Due to Immunologic Reactions to Foods in Infants and Young Children // J of Ped Gastroenterol and Nutr. 2000, Vol. 30, Issue 1, p. S87–94.
- Liacouras C. A., Bonis P., Putnam P. E. et al. Summary of the First International Eosinophil Research Symposium // Journal of Ped gastroenterol and Nutr. 2007. 45: 370–391.
- Khan S., Orenstein S. Eosinophilic Disorders of Gastrointestinal tract. In: Gastrointestinal and Liver Disease. Pathophysiology/Diagnosis/Management. 8 th ed. 2007: 543–556.
- Spergel J. M., Beausoleil J. L., Mascarenhas M. et al. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis // J Allergy Clin Immunol. 109: 363, 2002.
- Bonis P. A. L., Furuta G. T. Clinical Manifestation and Diagnosis of Eosinophilic Esophagitis. UpToDate, January 2011.
- Dahms B. B. Reflux Esophagitis: Sequelae and Differential Diagnosis in Infants and Children Including Eosinophilic Esophagitis. In: Perspectives in Pediatric Pathology. Alimentary Tract Pathology in Infants and Children. Vol. 25: 57–72.
- Kagalwalla A. F., Sentongo T. A., Ritz S. et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis // Clin Gastroenterol Hepatol. 2006; 4: 1097.
- Markowitz J. E., Spergel J. M., Ruchelli E., Liacouras C. A. Elemental diet is an effective treatment for eosinophilic esophagitis in children and adolescents // Am J Gastroenterol. 2003; 98: 777.
- Bonis P. A. L., Furuta G. T. Treatment of Eosinophilic Esophagitis. UpToDate, Feb., 2011.
- Lee M., Hodges W. G., Huggins T. L., Lee E. L. Eosinophilic gastroenteritis // South Med J. 1996; 89: 189.
- Rothenberg M. E. Eosinophilic gastrointestinal disorders (EGID) // J Allergy Clin Immunol. 2004; 113: 11.
- Van Dellen R. G., Lewis J. C. Oral administration of cromolyn in a patient with protein-losing enteropathy, food allergy, and eosinophilic gastroenteritis // Mayo Clin Proc. 1994; 69: 441.
- Bolukbas F. F., Bolukbas C., Uzunkoy A. et al. A dramatic response to ketotifen in a case of eosinophilic gastroenteritis mimicking abdominal emergency // Dig Dis Sci. 2004; 49: 1782.
- Vandenplas Y., De Greef E., Devreker T., Hauser B. Soy infant formula: is it that bad? // Acta Paediatr. 2011, Feb; 100 (2): 162–166. doi: 10.1111/j.1651–2227.2010.02021.x. Epub 2010 Oct 13.
- World Allergy Organization (WAO). Diagnosis and Rationale for Action against Cow_s Milk Allergy (DRACMA) Guidelines // Pediatr Allergy Immunol. 2010: 21 (Suppl. 21): 1–125.
- Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID-Sponsored Expert Panel // J Allergy Clin Immunol. 2010: V. 126, № 6.
- Host A., Koletzko B., Dreborg S., Muraro A., Wahn U., Aggett P., Bresson J. L., Hernell O., Lafeber H., Michaelsen K. F., Micheil J. L., Rigo J., Weaver L., Heymans H., Strobel S., Vandenplas Y. Dietary products used in infants for treatment and prevention of food allergy. Joint Statement of ESPACI and, ESPGHAN // Arch Dis Child.1999; 81: 80–84.
- American Academy of Pediatrics. Committee on Nutrition. Hypoallergenic infant formulas // Pediatrics. 2000; 106: 346–349.
- Commission DIRECTIVE 1999/21/ЕС of 25 March 1999 on dietary foods for special medical purposes.
- Moro G., Arslanoglu S., Stahl B., Jelinek J., Wahn U., Boehm G. A mixture of prebiotics oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age // Arch of Child. 2006: 91: 814–819.
- Gruber C., van Stuijvenberg M., Mosca F., Moro G., Chirico G., Braegger C. P., Riedler J., Boehm G., Wahn U. MIPS 1 Working Group. Reduced occurrence of early atopic dermatilis because of immunoactive prebiotics among low-atopy-risk infants // J Allergy Clin immunol. 2010; 126: 791–797.
- Osborn D. A., Sinn J. Soy formula for prevention of allergy and food intolerance in infants // Cochrane Database Syst Rev. 2006; 4: CD003741
- Agostoni C., Axelsson I., Goulet O., Koletzko B., Michaelsen K. F., Puntis J., Rieu D., Rigo J., Shamir R., Szajewska H., Turck D. Soy protein infant formulae and follow-on formulae: a commentary by the ESPGHAN Committee on Nutrition // J Pediatr Gastroenterol Nutr. 2006; 42: 352–361.
- Bhatia J., Greer F. American Academy of Pediatrics Committee on Nutrition. Use of soy-protein based formulas in infant feeding // Pediatrics. 2008; 121: 1062–1068.
- Vandenplas Y., De Greef E., Devreker T., Hauser B. Soy infant formula: is it that bad? // Acta Paediatr. 2011, Feb; 100 (2): 162–166. doi: 10.1111/ j.1651–2227.2010.02021.x. Epub 2010 Oct 13.
- Vandenplas Y. et al. Guidelines for the diagnosis and management of cow’s milk protein allergy in infants // Arch Dis Child. 2007; 92: 902–908.
- De Boissieu D., Dupont C. Allergy to extensively hydrolyzed cow’s milk proteins in infants: safety and duration of amino acid-based formula // J Pediatr. 2002, Aug; 141 (2): 271–273.
- Vanderhoof J. A. et al. Intolerance to protein hydrolysate infant formulas: an under recognized cause of gastrointestinal symptoms in infants // J Pediatr. 1997; 131: 741–744.
- Niggemann B. et al. Prospective, controlled, multi-center study on the effect of an amino acid based formula in infants with cow’s milk allergy/intolerance and atopic dermatitis // Pediatr Allergy Immunol. 2001, Apr; 12 (2): 78–82.
- De Boissieu D. et al. Allergy to extensively hydrolyzed cow milk proteins in infants: identification and treatment with an amino acid-based formula // J Pediatr. 1997; 131: 744–777.
Г. А. Новик, доктор медицинских наук, профессор
М. А. Ткаченко, кандидат медицинских наук, доцент
Санкт-Петербургская государственная педиатрическая медицинская академия, Санкт-Петербург
Контактная информация об авторах для переписки: mtkachenko2004@yahoo.com
Аллергия на эпителий кролика
Аллергия на эпителий кролика: показания и методика проведения анализа

Эпителий кролика – мощный аллерген, способный вызвать развитие патологической реакции организма. Сенсибилизация к нему встречается не часто, но при этом аллергия может протекать в тяжелой форме и стать причиной анафилаксии или отека Квинке. Для диагностики аллергии на эпителий кролика проводится иммунохемилюминесцентный анализ крови на наличие специфических иммуноглобулинов класса G. Исследование отличается высокой точностью и позволяет выявить антитела IgG даже при их незначительной концентрации.
Характерные последствия аллергии развиваются как после прямого контакта с кроликом, так и при косвенном влиянии, например, при вдыхании аллергена вместе с пылью. Пациентам, страдающим от подобного заболевания, нужно полностью исключить контакт с животным. В таком случае реакция будет постепенно сходить на нет и самостоятельно исчезнет через 4 недели.
В крови больных с аллергией на эпителий кролика присутствуют специфические аллергены IgG класса, что приводит к образованию иммунных комплексов, в которых IgG связываются с аллергенами. Эта аллергия не обнаруживается с помощью типичных кожных проб и не купируется антигистаминными средствами. Симптомы развиваются не сразу, поэтому пациент не всегда может связать их и контакт с животным.
Поскольку у части людей, страдающих от подобной аллергии, антитела IgG становятся блокаторами, то реакция прекращается сразу после связывания антител и аллергена.
Цель анализа: определить специфические антитела IgG, скоррелировать полученные результаты с клиническими признаками аллергии и установить показатель специфических антител IgE (он должен быть отрицательным).
Почему возникает аллергия?
Развитие аллергической реакции вызывают микрочастицы, которые присутствуют в слюне кролика и его моче. Попадая на шерсть животного и его кожу, данные микрочастицы смешиваются с пылью после чего, вместе с воздушными потоками они могут переносится на значительные расстояния. Микрочастицы эпителия кролика попадают в человеческий организм воздушно-капельным путем. Это вызывает в организме интенсивную выработку специфических иммуноглобулинов класса G. Вследствие этого поражаются внутренние ткани и органы.
Факторы риска

Аллергия на эпителий кролика может быть обусловлена отягощенной наследственностью. Чаще данное патологическое состояние встречается у пациентов, имеющих непосредственный контакт с кроликами на протяжении длительного периода времени. Это могут быть люди, занимающиеся разведением кроликов, а также те, кто обзавелся декоративным кроликом, который содержится в домашних условиях. В группе риска находятся люди с ослабленным иммунными силами организма и наличием хронических заболеваний. Особенно аллергии на эпителий кролика подвержены маленькие дети на первом году жизни, поскольку их иммунитет еще должным образом не сформирован. Предрасположены к аллергии и беременные женщины.
Показания для проведения анализа
Проведение исследования крови, направленное на выявление иммуноглобулинов класса G показано при подозрении на возможную аллергическую реакцию на эпителий кролика при наличии у пациентов следующих симптомов:
- сонливость, общая слабость организма;
- учащенное сердцебиение;
- головокружение;
- понижение показателей артериального давления;
- продолжительный кашель без отхождения мокроты;
- обильное выделение бесцветной слизи из носа;
- припухлость век;
- светобоязнь;
- предобморочное состояние.
В качестве тяжелых и опасных для жизни проявлений аллергии на эпителий кролика отмечается анафилактический шок и отек Квинке.
Методика проведения анализа
Применяется иммунохемилюминесцентный анализ (ИХЛА). Это самый точный из способов установления специфических антител в современной лабораторной диагностике. В его основе заложены особенности иммунологической реакции: на стадии обнаружения специфических антител, к ним присоединяют вещества, способные светиться в темноте. Это люминофоры. Уровень подсвечивания рассчитывается в пропорции к выявленному количеству антител и подлежит измерению посредством специального прибора — люминометра.

Биоматериал, необходимый для проведения анализа — кровь из вены пациента.
Подготовки к анализу:
- За 4 часа до сдачи биоматериала рекомендуется отказаться от приема пищи. Допустимо употребление обычной питьевой воды.
- Нежелательно сдавать анализ в период приема лекарственных средств на основе глюкокортикоидных гормонов. В таком случае необходимо предварительно проконсультироваться со специалистом по вопросу отмены назначенного медикамента.
- За 3 дня до проведения исследование следует исключить из рациона продукты, богатые биотином (витамин В7). К их числу относятся почки и печень, орехи, соевые бобы, орехи, горох, вареные яйца, капуста, шпинат, шампиньоны.
- Крайне нежелателен прием лекарственных препаратов, в состав которых входит биотин (терапию целесообразно отменить за двое суток до сдачи анализа).
- Высокая доля биотина в образце способна стать причиной интерференции (искажение результатов исследования в сторону занижения).
Особенности исследования:
- Прием антигистаминных средств не влияет на точность данных анализа.
- Исследование является для пациента абсолютно безопасным, поскольку не предусматривает искусственно созданный непосредственный контакт с аллергеном.
Интерпретация результатов анализа
Анализ проводится по типу: кролик (эпителий, аллерген e82), IgG антитела.
Все значения даются в референсной трактовке:
- «+++»: однозначная положительная реакция.
- «++»: умеренно-положительная.
- «+»: слабоположительная.
- «-»: отрицательная, антитела к данному аллергену не выявлены (считается нормой).
Повышенные количественные значения антител могу свидетельствовать как о протекающей аллергической реакции, так и о том, что организм способен самостоятельно блокировать реакцию на такой тип аллергена. Оценить полученные результаты может только врач, ориентируясь на анамнез. Отрицательный результат, приравнивающийся к норме, говорит об отсутствии антител IgG класса и опосредованной через них реакции, но при этом не исключена IgE — зависимая аллергия.

В целом анализ дает возможность обнаружить замедленную аллергическую реакцию к данному аллергену (эпителий кролика)
Причины положительного результата:
- Сенсибилизация организма к эпителию кролика;
- развитие потенциально возможной перекрестной аллергии на эпителий кролика.
Причины отрицательного результата:
- Отсутствие аллергической реакции на эпителий кролика;
- проведение курса медикаментозной терапии (при сдаче анализа в динамике);
- отсутствие контакта с аллергеном.
Принципы терапии
Лечение аллергической реакции на эпителий кролика строится на основе двух важных начал. Первое – профилактика. Она подразумевает полный отказ от непосредственного взаимодействия с аллергеном. Второе – проведение медикаментозной терапии, направленной на купирование симптомов и предотвращение их возникновения в дальнейшем.
Особенности лечения
Схема лечения подбирается врачом в каждом случае индивидуально, с учетом специфики проявления патологической реакции и сведений о состоянии здоровья пациента. Как правило, терапия не обходится без назначения антигистаминных средств. Учитывая, что проявления аллергии на эпителий кролика носят длительный характер, обычно назначают препараты второго поколения. Они эффективно блокируют выход гистамина и при этом отличаются быстротой своего действия. Терапия включает в себя сосудосуживающие глазные или назальные капли, противовоспалительные, противоотечные средства, энтеросорбенты, глюкокортикостероиды, имеющие системное или местное действие.

- полное исключение (а при его невозможности ограничение) контакта с кроликами;
- тщательная уборка за кроликом, содержание его в закрытой клетке или отдельном помещении;
- прием душа и стирка одежды после проведения мероприятий по уходу за животным (кормление, чистка клеток);
- введение здорового образа жизни, правильное сбалансированное питание, необходимые для стимуляции активного функционирования иммунной системы.
Аллергия на эпителий кролика способна вызвать серьезные сбои в работе организма. Для ее своевременной диагностики, проведения необходимой терапии и во избежание развития осложнений патологического процесса необходимо, при наличии к тому оснований, сдать анализ крови на наличие в нем специфических антител IgG к данному аллергену.
Пищевая аллергия
Пищевая аллергия – специфическая реакция организма, которая проявляется после употребления в пищу определенных продуктов питания (или их ингредиентов). Чаще всего подобную защитную реакцию вызывает белок, реже – жиры и/или углеводы.

Людям, склонным к пищевой аллергии следует знать, что одно и то же блюдо может включать несколько аллергенов, которые будут восприниматься их организмом как вещества, несущие потенциальную опасность.
Аллергией на продукты питания страдают и взрослые, и дети. Однако у детей младшего возраста такая проблема наблюдается чаще, чем у взрослых (в силу особенностей протекания физиологических процессов и не оформившегося иммунитета). Специалисты отмечают, что в последние годы по всему миру стабильно увеличиваются число людей, подверженных данному заболеванию.
Причины пищевой аллергии
Принято считать, что патология имеет наследственную природу. Если один из родителей имеет склонность к аллергии, то вероятность возникновения такой же реакции на некоторые пищевые продукты у малыша достаточно высока. При двух родителях-аллергиках ребенок практически всегда имеет ту же самую проблему.

Справка. Нередко диагностируется аллергия перекрестного типа. Это означает, что у человека имеется реакция на определенные продукты, вызывающие аллергию. Например, при употреблении фасоли таковая была обнаружена. Значит, существует опасность подобного ответа организма и на другие бобовые культуры. При этом если человек ел фасоль впервые, негативных последствий может и не быть, они развиваются после повторного употребления блюда. В этом случае повторный либо длительный прием какого-либо продукта питания приводит к распознанию организмом аллергена и реагированием на раздражитель характерной симптоматикой.
Продукты питания, вызывающие аллергию
| Высокая | Средняя | Низкая |
| Коровье молоко, рыба, яйцо, орехи (кешью, лесной, грецкий, арахис, фундук, фисташки), грибы, мёд, куриное мясо, морковь, цитрусовые, клубника, земляника, виноград, гранат, малина, дыня, ананас, шоколад, кофе, какао. | Свинина, индейка, кролик, красная смородина, клюква, персики, абрикосы, картофель, горох, перец зеленый, кукуруза, капуста, греча, рис. | Конина, баранина, кабачки, патиссоны, репа, тыква, кисло-сладкие яблоки, бананы, белая смородина, крыжовник, слива, арбуз, миндаль, черешня белая, огурец. |
Продукты, которые могут вызвать аллергию, делятся на три вида по степени потенциальной аллергенности: высокая, средняя и низкая. Примеры аллергенных продуктов приведены в таблице ниже.
Важно! Помощь аллергику невозможно оказать без выявления аллергена по таблице продуктов с высоким аллергическим потенциалом. Состояние пациента оценивается после употребления им того или иного продукта.
Перекрестная пищевая аллергия
| Коровье молоко | Козье молоко, продукты, содержащие белки коровьего молока, говядина, телятина и мясопродукты из них, шерсть коровы. |
| Кефир | Плесневые грибы, плесневые сорта сыров (рокфор, бри, дор-блю и т. п.), дрожжевое тесто, квас, антибиотики пенициллинового ряда, грибы |
| Рыба | Морепродукты (крабы, креветки, икра, лангусты, омары, мидии и др.) |
| Куриное яйцо | Куриное мясо и бульон, перепелиные яйца и мясо, мясо утки, соусы, кремы, майонез с включением компонентов куриного яйца, перо подушки, лекарственные препараты (интерферон, лизоцим, бифилиз, некоторые вакцины) |
| Морковь | Петрушка, сельдерей, b-каротин, витамин А |
| Клубника | Малина, ежевика, смородина, брусника |
| Яблоки | Груша, айва, персик, слива |
| Картофель | Баклажаны, томаты, перец стручковый зеленый и красный, паприка, табак |
| Орехи | Киви, манго, мука (рисовая, гречневая, овсяная), кунжут, мак |
| Бананы | Киви, дыня, авокадо |
| Бобовые | Арахис, соя, горох, фасоль, чечевица, манго, люцерна |
| Слива | Миндаль, абрикосы, вишня, нектарины, персики, дикая вишня, черешня, чернослив, яблоки |
Ранее пациентам часто не могли подобрать оптимальный вариант питания и лечения (даже при условии обнаружения основного раздражителя). У многих больных при отсутствии взаимодействия с аллергеном симптомы не исчезали вообще или начинался рецидив. Это побудило ученых к проведению полномасштабных исследований. Был введен термин «перекрестная аллергия» и сейчас в медицине используются новые подходы для составления ежедневного меню и подбора лекарств.
Пример. У пациента выявлена истинная аллергия на пшеницу. Она при определенных условиях развивается и на другие злаки. Значит, необходимо исключить из продуктов питания все эти злаки.
Специалисты разработали перечень двойников-аллергенов, при контакте с которыми у пациентов может развиться негативная реакция. При составлении таблиц перекрестной пищевой аллергии используется следующий принцип – аллерген, вызывающий основную реакцию берется за основу. Затем выявляют группы раздражающих веществ, которые имеют аналогичное строение (а значит и идентичную реакцию организма).
Симптомы заболевания
Сразу после употребления пищи появляется отек губ и полости рта. Затем (по мере продвижения пищи по пищеварительному тракту) присоединяется следующая симптоматика:
При тяжелой форме болезни возможно появление негативных реакций уже только при запахе и прикосновении к определенным продуктам питания. В этом случае у больного может развиться аллергия в нескольких органах.
- Отеканием глотки, зудом.
- Значительными высыпаниями на коже.
- Обильным потоотделением.
- Резким падением кровяного давления.
- Угнетением дыхания.
Если больному не оказана грамотная врачебная помощь, развивается анафилактический шок, при котором высока вероятность летального исхода.
Диета при пищевой аллергии
Лечебно-профилактическое питание при пищевой аллергии предполагает:
- полное исключение из ежедневного меню тех продуктов, которые вызывают негативную симптоматику;
- некоторое ограничение количества блюд, имеющих среднюю аллергенную активность.
Обычному человеку достаточно сложно самостоятельно разработать грамотный индивидуальный алгоритм питания. Поэтому для лечения пищевой аллергии и подбора оптимального способа питания следует обращаться к квалифицированным специалистам. Не следует пользоваться никакими диетами, которые публикуются в околонаучных статьях в интернете!
Медики рекомендуют в последующем, после постановки диагноза, постепенно и под наблюдением лечащего врача вводить в рацион ряд пищевых продуктов с целью выявления индивидуальных реакций организма на каждый из них.
Совет. Людям, у которых диагностировано данное заболевание, следует внимательно изучать информацию на упаковке перед покупкой товара в магазине. Нередко аллергические реакции бывают на продукты, относящиеся низкоаллергенной группе. Поэтому подбор диеты должен проводиться в индивидуальном порядке.
От больного требуется самодисциплина и четкое соблюдение предписаний врача. Разумным решением будет питаться каждым из продуктов один раз в 4-5 дней. Возможно, реакция развивается не на конкретное блюдо, а на накопление определенного аллергена из него, когда он поступает в организм регулярно и концентрируется в нем.
Следует понимать, что соблюдая даже самую строгую гипоаллергенную диету, нужно, тем не менее, уделять должное внимание разнообразию рациона. Включая каждый день в пищу разрешенные продукты, следует стремиться к тому, чтобы организм получал весь набор жизненно важных компонентов (белки, углеводы, витамины, жиры, макро- и микроэлементы). В противном случае человек будет испытывать дефицит полезных веществ и это приведет к развитию разнообразных патологий и ухудшению самочувствия.
Лечение
Основной метод, широко применяемый для действенного лечения пищевой аллергии –элиминационная диета. Это означает, что пациенту запрещено употреблять на время отдельные продукты, аллергический ответ на которые был точно установлен. Такой вид терапии используют как для взрослых, так и для детей, включая малышей с аллергией на молочные продукты. Практика показывает, что в большинстве случаев симптоматика заболевания полностью исчезает через определенный промежуток времени.
Внимание! Лечением заболевания с помощью лекарств от пищевой аллергии занимается только врач! Нельзя самостоятельно приобретать любые медикаменты и экспериментировать с ними. Существуют качественные лекарства, которые доказали свой высокий эффект в ходе клинических испытаний и практического применения. Они активно используются во время обострения (под строгим наблюдением опытного врача).
Профилактика
К профилактическим мерам относят регулярное наблюдение у специалистов, прохождение обследований, четкое выполнение предписаний врача, соблюдение правил питания и прием лекарственных средств. Препараты для лечения и профилактики заболевания рекомендовано приобретать у солидных поставщиков. Социальные аптеки Столички – это безупречная репутация, выгодные цены и гарантия качества всех медикаментов.
Железодефицитная анемия у детей
Почему при ЖДА необходимы препараты железа? В чем преимущества препаратов последнего поколения? Почему прием препаратов железа должен быть длительным? Картина крови при хронической железодефицитной анемии. Выраженные гипохромия эритроци
Почему при ЖДА необходимы препараты железа?
В чем преимущества препаратов последнего поколения?
Почему прием препаратов железа должен быть длительным?
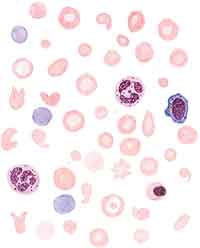 |
| Картина крови при хронической железодефицитной анемии. Выраженные гипохромия эритроцитов, анизоцитоз, пойкилозитоз, шизоцилы, присутствие полихроматофилов |
Анемия — это патологическое состояние, характеризующееся снижением массы эритроцитов, часто в сочетании с уменьшением количества эритроцитов в единице объема крови. Причин возникновения анемий очень много; для детского же возраста наиболее типична железодефицитная анемия (ЖДА). ЖДА характеризуется наличием небольших гипохромных эритроцитов и истощением запасов железа в организме.
Распространенность дефицита железа у детей в раннем возрасте, по данным ВОЗ, составляет от 17,5 до 30%.
Можно выделить следующие причины развития дефицита железа у детей.
- Недостаточные запасы железа при рождении. Недоношенные дети, а также дети от матерей, страдавших во время беременности анемией, относятся к группе риска по развитию ЖДА. Состояние плаценты также имеет огромное значение, поскольку положительный баланс железа у плода обусловлен совершенными транспортными механизмами плаценты.
- Недостаточное поступление железа с пищей и нарушение всасывания в желудочно-кишечном тракте. Имеет значение не cтолько содержание железа в продукте, сколько эффективность его всасывания и усвоения. Железо всасывается в двенадцатиперстной и тощей кишках, поэтому при различных заболеваниях пищеварительного тракта (хронический энтерит, синдром мальабсорбции) также может развиваться дефицит железа в силу нарушения его всасывания.
- Повышенная потребность в железе в связи с ростом, интенсивными процессами дифференцировки тканей, созревания различных органов и систем, увеличением объема циркулирующей крови. Особенно высока потребность в железе в период вытяжения, пубертатный период и во время становления менструальной функции у девочек-подростков.
- Избыточная потеря железа организмом. Это прежде всего кровопотеря: кровотечения различной локализации (при заболеваниях пищеварительного тракта — язвенные процессы, полипы, сосудистые аномалии, носовые), глистная инвазия, менструации у девочек-подростков. Избыточная потеря железа может быть при выраженных аллергических проявлениях на коже за счет потери микроэлемента со слущивающимся эпителием, при частых ОРВИ у детей, поскольку вирусы и бактерии используют железо ребенка для своих метаболических процессов.
Важно отметить, что у детей раннего возраста причинами дефицита железа, как правило, являются недостаточное депо железа и нерациональное питание, а у детей старшего возраста — кровопотеря и резкое вытяжение.
Патофизиологические аспекты
Поскольку всасывание железа ограничено, у большинства людей его поступление с пищей едва покрывает текущую потребность организма, в результате заболеваний или неправильного питания довольно легко развивается дефицит железа. Этот процесс состоит из нескольких стадий.
Стадия 1. Потеря железа превышает его поступление. На фоне отрицательного баланса железа его запасы в костном мозге постепенно истощаются. Хотя уровень железа в сыворотке и количество гемоглобина остаются нормальными, содержание ферритина в сыворотке уменьшается (ниже 20 нг/мл). По мере истощения запасов железа происходит компенсаторное повышение концентрации трансферрина (о чем свидетельствует увеличение железосвязывающей способности).
Стадия 2. Истощенные запасы железа уже не обеспечивают эритропоэтическую функцию костного мозга. В то время как уровень трансферрина в плазме растет, содержание железа в сыворотке снижается, что приводит к его всевозрастающей нехватке при образовании эритроцитов. Эритропоэз нарушается, когда уровень железа ниже 50 мкг%, а насыщение трансферрина — ниже 16%. Возрастает концентрация рецепторов ферритина в сыворотке (более 8,5 мг/л).
Стадия 3. Анемия при внешне нормальных эритроцитах и эритроцитарных индексах.
Стадия 4. Развитие микроцитоза и затем гипохромии.
Стадия 5. Дефицит железа сопровождается симптомами тканевых нарушений.
Клинические проявления
Представление о клиническом статусе больного с анемией зависит от основного заболевания и формы анемии (острой или хронической). ЖДА — состояние хроническое. Проявление анемии per se объясняют с помощью патофизиологических механизмов. Большинство симптомов ЖДА являются отражением сердечно-сосудистых и газообменных изменений, компенсирующих уменьшение массы эритроцитов. Степень выраженности симптомов зависит от скорости развития анемии (при медленном развитии анемии, характерном для железодефицитных состояний, времени для полного развития компенсаторных механизмов достаточно) и ее длительности. Даже анемия средней тяжести нередко протекает бессимптомно. Ребенок может жаловаться на усталость, одышку и сердцебиение, особенно после физической нагрузки. При тяжелой анемии симптоматика сохраняется и в состоянии покоя, больной не может переносить физические нагрузки. Если уровень гемоглобина менее 75 г/л, то минутный сердечный выброс в покое заметно повышается по мере увеличения как частоты сердечных сокращений, так и ударного объема. Симптомы сердечной недостаточности развиваются, когда резерв миокарда исчерпан. Следовательно, тяжесть состояния больного определяется прежде всего степенью выраженности сердечно-сосудистых нарушений.
Симптоматика при анемии средней и тяжелой степени распространяется и на другие системы органов. Больной часто жалуется на головокружение и головные боли, шум в ушах, возможен даже обморок. Человек становится раздражительным, нарушается сон, снижается концентрация внимания. Поскольку кровоток в коже снижен, может развиваться гиперчувствительность к холоду. Возникает симптоматика и со стороны желудочно-кишечного тракта — резкое снижение аппетита, диспепсические расстройства (тошнота, изменение характера и частоты стула), прежде всего это происходит за счет шунтирования крови, минующей сосудистое русло внутренних органов. У девочек-подростков нарушается менструальный цикл, что проявляется в виде аменореи или обильного кровотечения.
Основной признак анемии — бледность кожных покровов. Однако его информативность ограничена другими факторами, определяющими цвет кожи.
Поэтому наиболее информативным признаком анемии является бледность видимых слизистых — слизистой оболочки полости рта, ногтевого ложа и конъюнктивы век. Информативным также считается цвет кожи на сгибах ладонной поверхности — если по цвету они не отличаются от окружающей кожи, то уровень гемоглобина у больного, как правило, менее 80 г/л.
Развитие бледности кожных покровов при анемии объясняется двумя факторами: первый — это, несомненно, уменьшение уровня гемоглобина в крови, второй — шунтирование крови в обход сосудов кожи и других периферических тканей, способствующее усиленному кровоснабжению жизненно важных органов. Перераспределение кровотока представляет собой один из важных механизмов компенсации анемии.
Из других клинических симптомов анемии следует отметить уже упоминавшиеся выше тахикардию, значительные колебания пульсового давления, систолический шум изгнания над предсердиями, снижение умственной и физической активности, дети становятся раздражительными, быстро утомляются, их сон беспокойный, аппетит снижен.
При ЖДА к обычным симптомам анемии присоединяются признаки, специфичные для недостаточности железа. При длительном дефиците железа появляются извращенные аппетит (поедание мела, грязи, красок) и обоняние (нравятся резкие запахи бензина, красок, лаков, поедание льда (пагофагия), развиваются глосситы, хейлит, койлонихия (истонченные, исчерченные, ломкие ногти). При дефиците железа падает активность иммунной системы за счет снижения синтеза ИЛ-2, Т-киллеров; дети чаще болеют ОРВИ, что, в свою очередь, усугубляет имеющийся дефицит железа.
Диагноз подтверждается лабораторными данными. Критерием диагностики ЖДА является анемия микроцитарная, гипохромная, норморегенераторная. Для ЖДА характерны анизоцитоз, тромбоцитоз, снижение уровня сывороточного железа (менее 13 ммоль/л), общая железосвязывающая способность сыворотки не изменена или повышена, уровень сывороточного ферритина менее 15 нг/мл, насыщение трансферрина меньше 16%, уровень протопорфирина эритроцитов повышен, уровень Hb A2 снижен, в костном мозге отмечается раздражение красного ростка (эритроциты : гранулоциты = 1:1 — 1:2), типично отсутствие в костном мозге запасов железа и кольцевидных сидеробластов.
В дифференциально-диагностический поиск включаются талассемия, отравление свинцом, анемия при хронических заболеваниях, врожденные нарушения обмена железа (дефицит трансферрина, нарушение утилизации железа, нарушение реутилизации железа), гемосидероз, в том числе синдром Гудпасчера, дефицит меди.
Принципы лечения ЖДА у детей
- Устранение причин, лежащих в основе развития дефицита железа.
- Терапия ЖДА должна проводиться препаратами железа, поскольку возместить дефицит железа при этом состоянии только диетотерапией невозможно, истинный дефицит железа не сопровождается дефицитом витаминов В12, В6, фолиевой кислоты.
- Цель терапии препаратами железа — устранение дефицита железа в организме, а не просто нормализация уровня гемоглобина, поэтому срок лечения длительный (не менее 3 месяцев).
- Терапия ЖДА проводится преимущественно пероральными препаратами железа.
- Гемотрансфузии при ЖДА проводятся только по жизненным показаниям.
Диетотерапия при ЖДА у детей
В настоящее время общепризнано, что устранить дефицит железа в организме только с помощью диетотерапии невозможно. Это связано с тем, что всасывание железа из пищевых продуктов ограничено — 1,8-2 мг (не более 2,5 мг) железа в сутки — даже при рациональном питании, соответствующем возрасту, и при потреблении достаточного количества продуктов с высоким содержанием железа. (Для сравнения: здоровый ребенок в зависимости от возраста теряет за сутки от 0,15 до 0,6 мг железа, девочка во время месячных — 15-50 мг) При приеме современных препаратов железа оно усваивается в 20 раз лучше. Диетотерапия должна быть одной из составляющих терапии ЖДА у детей.
С другой стороны, очень важно ориентироваться не на содержание железа в продуктах питания, а на его форму. Именно форма железа определяет процент его всасывания и усвоения и, следовательно, эффективность терапии. Из различных форм железа легче всего усваивается гемовое железо — сложное органическое соединение, в котором железо находится в составе гемоглобина; неорганические соединения — соли железа — усваиваются организмом значительно хуже. Железо в составе гема активно захватывается клетками слизистой кишечника и всасывается в неизмененном виде. Процессы всасывания гема в кишечнике не зависят от кислотности среды и активности пищевых ферментов. Железо из злаков, овощей, фруктов всасывается значительно хуже из-за присутствия в них ингибиторов ферроабсорбции, таких, как оксалаты, фосфаты, танин и другие. Сравните: коэффициент усвояемости железа из говядины (гемовое железо) составляет 17-22%, из фруктов — не более 3%. Степень усвояемости железа из продуктов животного происхождения также зависит от формы железосодержащих соединений. Так, из печени, где соединения железа представлены в виде ферритина и трансферрина, железо усваивается в значительно меньшем количестве, чем из мясных продуктов, хотя общее содержание железа в печени в 3 раза больше, чем в мясе. Поэтому включение печени в рацион питания для устранения дефицита железа или с профилактической целью не имеет никакого смысла. Таким образом, рацион питания должен быть максимально богат продуктами, в которых железо содержится в виде гема (язык говяжий, мясо кролика, говядина).
Необходимо отметить также, что мясо, печень и рыба улучшают всасывание железа из фруктов и овощей при одновременном их употреблении.
Всасываемость железа из злаковых, бобовых, клубневых, овощей, фруктов значительно ниже, поскольку железо в них содержится в негемовой форме, и во многом зависит от содержания в рационе веществ, ингибирующих или потенцирующих всасывание железа. Усиливают всасывание негемового железа аскорбиновая кислота, продукты из мяса, птицы, рыбы, а также вещества, понижающие кислотность пищи (например, молочная кислота). Снижают усвоение негемового железа соевый протеин, полифенолы, входящие в состав чая, кофе, орехов и бобовых. Несмотря на высокое содержание железа в некоторых продуктах растительного происхождения, они не могут обеспечить высокую потребность в железе, характерную для растущего организма, поскольку железо из них всасывается значительно хуже, чем из продуктов животного происхождения. Рекомендации употреблять в больших количествах фруктовые соки, яблоки, гранаты, гречневую крупу и другие продукты в целях восполнения депо железа при ЖДА также нельзя считать обоснованными. Сбалансированная по основным ингредиентам диета позволяет «покрыть» только физиологическую потребность организма ребенка в железе, но никак не устраняет дефицита железа и должна использоваться в комплексе с препаратами железа при лечении ЖДА. Однако полноценная и сбалансированная диета занимает важное место в профилактике развития дефицита железа в организме ребенка во все периоды детства.
Медикаментозная терапия при ЖДА
Основной задачей терапии ЖДА является устранение дефицита железа в организме ребенка. Это достигается благодаря приему железосодержащих лекарственных препаратов. Основные требования, предъявляемые к препаратам железа, — это достаточное содержание в них элементарного железа и отсутствие побочных эффектов и осложнений. В настоящее время на фармацевтическом рынке России достаточный выбор препаратов железа, что расширяет возможности врача и позволяет учитывать индивидуальные особенности пациентов при назначении лечения (табл. 1). В частности, появились удобные формы для детей младшего возраста — капли и сироп (феррум лек, мальтофер, актиферрин, гемофер).
Все препараты зарегистрированы и разрешены к применению в Российской Федерации.
Современные препараты железа разделяют на две группы:
- ионные железосодержащие препараты (солевые, полисахаридные соединения железа);
- неионные соединения, т. е. препараты, представленные гидроксид-полимальтозным комплексом трехвалентного железа (феррум лек, мальтофер).
Усвояемость железа из лекарственного препарата зависит от содержания в нем элементарного (активного) железа. Наибольшее количество элементарного железа содержится в препаратах, в которых железо представлено в виде фумарата (ферретаб, ферронат) или сульфата двухвалентного железа (актиферрин, ферро-фольгамма, гемофер пролангатум, ферро-градумет). В настоящее время появились препараты железа нового поколения, к которым относятся лекарственные средства, представленные гидроксид-полимальтозным комплексом трехвалентного железа (мальтофер, феррум лек). Особенностью этих препаратов является то, что поступление железа из кишечника в кровь происходит путем активного всасывания в отличие от солевых соединений железа, всасывание которых происходит по градиенту концентрации. Это важно, поскольку исключается возможность передозировки препаратов железа, содержащих гидроксид-полимальтозный комплекс трехвалентного железа.
Солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи и с другими лекарствами, что затрудняет абсорбцию железа. Поэтому эта группа препаратов железа назначается за час до еды. Однако на фоне выраженного свободнорадикального стресса, возникающего при взаимодействии железа со слизистой кишечника во время его диффузии, усиливается повреждающее действие на слизистую кишечника соединений железа, что проявляется диспепсическими расстройствами, вплоть до некроза слизистой. При плохой переносимости солевых препаратов железа их можно принимать и во время еды, что уменьшит побочные проявления, но и всасывание железа в свою очередь будет ухудшаться. Солевые препараты железа нельзя запивать чаем, молоком и сочетать их с приемом некоторых медикаментов (тетрациклинов, левомицетина, препаратов кальция, антацидов, пеницилламина), поскольку при этом снижается усвояемость железа.
Препараты неионного железа, как показывают проведенные исследования, не взаимодействуют с компонентами пищи и лекарствами, что позволяет использовать эти препараты, не нарушая режима питания детей (препараты можно добавлять в пищу, соки) и схемы терапии сопутствующей патологии (если есть необходимость в проведении такого лечения).
Суточная терапевтическая доза препаратов железа должна быть достаточной для нормализации уровня гемоглобина и восполнения запасов железа в костном мозге, что составляет для солевых препаратов железа 3-6 мг/кг/сут элементарного железа в два-три приема. Гидроксид-полимальтозный комплекс железа (феррум лек) назначается в дозе 3-6 мг/кг/сут в один или несколько (по желанию пациента) приемов.
Побочные реакции при приеме препаратов железа
Наиболее часто при лечении ферропрепаратами наблюдаются следующие побочные явления (табл. 2): металлический привкус во рту, потемнение эмали зубов, аллергические высыпания на коже, диспепсические нарушения в результате раздражающего действия на слизистую пищеварительного тракта, прежде всего кишечника (жидкий стул, тошнота, рвота). Поэтому начальные дозы препаратов должны составлять 1/2-1/3 терапевтической с последующим увеличением их до полной дозы в течение нескольких дней во избежание возникновения выраженных побочных действий. При непереносимости солевого препарата его можно заменить гидроксид-полимальтозным комплексом железа, в результате применения которого не возникает вышеописанных эффектов. Гидроксид-полимальтозный комплекс железа можно сразу применять в полной дозе. Неионные препараты железа не вызывают перечисленных выше побочных эффектов, чувство переполнения желудка также отмечается редко.
Парентеральное введение препаратов железа
Парентеральное введение препаратов железа проводится только по строгим показаниям из-за развития выраженных местных и системных побочных эффектов. Показания таковы: патология пищеварительного тракта (синдром нарушенного кишечного всасывания, неспецифический язвенный колит, хронический энтероколит, желудочно-кишечное кровотечение) и непереносимость железосодержащих препаратов при пероральном приеме.
Противопоказаниями к назначению препаратов железа являются анемии, не обусловленные дефицитом железа (гемолитические, апластические), гемосидероз, гемохроматоз.
Продолжительность курса лечения
Клинический и терапевтический эффекты при пероральной ферротерапии развиваются постепенно. Через некоторое время появляется клиническое улучшение: уменьшается слабость, исчезает головокружение, ребенок становится более активным, повышается аппетит, постепенно розовеют кожные покровы и видимые слизистые. На 8-10-й день терапии отмечается ретикулоцитарный криз — до 5%, что подтверждает эффективность лечения. Позже наблюдается повышение уровня гемоглобина, чаще всего нормализация гемоглобина происходит на 3-6-й неделе от начала терапии и зависит от степени тяжести анемии. В среднем уровень Hb повышается на 10 г/л за 10 дней. Однако нормализация уровня гемоглобина не является признаком устранения дефицита железа. Для полного восполнения депо железа в организме курс ферротерапии должен составлять не менее 3 месяцев.
Причины неэффективности ферротерапии
Неэффективность терапии на фоне приема препаратов железа при их хорошей переносимости может быть обусловлена следующими факторами:
- неправильный диагноз,
- продолжающаяся кровопотеря,
- интеркуррентные заболевания (ОРВИ, обострение хронических очагов инфекции).
ЖДА — это заболевание, при правильной терапии которого наступает полное выздоровление!
Лечение пищевой аллергии
Питание относится к жизнеобеспечивающей функции, поэтому к жалобам пациента на непереносимость каких-либо пищевых продуктов следует относиться максимально внимательно. Современная классификация непереносимости пищи включает следующие варианты. Исти

Питание относится к жизнеобеспечивающей функции, поэтому к жалобам пациента на непереносимость каких-либо пищевых продуктов следует относиться максимально внимательно.
Современная классификация непереносимости пищи включает следующие варианты.
- Истинная пищевая аллергия, т. е. непереносимость пищи, обусловленная иммунологическими механизмами.
- Псевдоаллергические реакции, связанные с гистаминолиберирующими свойствами некоторых пищевых продуктов и пищевых добавок.
- Непереносимость пищи в связи с наличием дефицита пищеварительных ферментов.
- Психогенные реакции на пищу.
Физиологическая функция желудочно-кишечного тракта (ЖКТ) заключается в переваривании пищи. В результате химических преобразований пищевые белковые структуры превращаются в аминокислоты, которые всасываются и являются источником энергии и роста. Поэтому осмысление механизмов пищевой непереносимости невозможно без оценки функции ЖКТ в целом.
Вначале пища обрабатывается в полости рта. Происходит измельчение пищевого комка, на него действуют ферменты, которые выделяются слюнными железами и имеют щелочную реакцию. Дальнейшая обработка пищи происходит в желудке, где она подвергается воздействию соляной кислоты. Желчь эмульгирует жиры. Ферменты поджелудочной железы участвуют в переработке мышечных волокон, крахмала, клетчатки. В дальнейшем пищевой комок (химус) поступает в кишечник, где заканчивается переваривание пищи кишечными соками с участием нормальной микрофлоры кишечника.
Существенное значение играет превращение антигена (аллергена) в кишечнике в неаллергенную или толерогенную форму.
ЖКТ также выполняет функцию защитного барьера для любых патогенов: в него ежедневно поступает большое количество чужеродных белков пищевого, бактериального, паразитарного и вирусного происхождения.
Саморегуляция ЖКТ осуществляется при помощи многочисленных нейропептидов APUD-системы (гастрины, соматостатин, холецистокинин, простагландины, вазоактивный кишечный пептид и др.). Пептические гормоны являются веществами, которые осуществляют взаимосвязь между иммунной, эндокринной и нервной системами.
В пищеварительном тракте определяется толерантность к чужеродным белкам, содержащимся в пище. ЖКТ имеет собственную иммунную систему — ассоциированную с кишечником лимфоидную ткань, состоящую из следующих компонентов: скоплений лимфоидных фолликулов, расположенных на всем протяжении слизистой и подслизистой оболочек кишечника, включая пейеровы бляшки и червеобразный отросток, внутриэпителиальных лимфоцитов, плазматических клеток и других клеток слизистой оболочки, брыжеечных лимфатических узлов. Высокие концентрации IgA в кишечной слизи усиливают ее барьерные функции. Важная роль принадлежит факторам как местного, так и системного иммунитета.
Слово «аллергия» происходит от греческих слов «аллос» (другой, иначе) и «эргос» (действие) и в переводе означает «другое действие». В современной науке данное понятие определяется следующим образом: аллергия — это состояние повышенной реакции организма на какие-либо вещества чужеродной природы, в основе которой лежат иммунологические механизмы. Патологические состояния, характеризующиеся образованием антител и специфически реагирующих лимфоцитов, развиваются в ответ на контакт с соответствующими аллергенами, которые рассматриваются как этиологические факторы болезни. Как правило, аллергены — это вещества белковой природы, обладающие определенными свойствами (чужеродность, иммуногенность, специфичность).
Все аллергены принято делить на две группы: эндоаллергены, образующиеся в самом организме, и экзоаллергены, попадающие в организм извне. Экзоаллергены могут быть инфекционного и неинфекционного происхождения. Аллергены различаются по способу поступления в организм человека: ингаляционные (попадают в организм при дыхании) и энтеральные — попадающие внутрь через пищеварительный тракт.
Энтеральным путем в организм человека поступают аллергены лекарственного или пищевого происхождения (пищевые продукты, пищевые добавки, т. е. консерванты, красители, эмульгаторы и др.).
На воздействие аллергена организм реагирует повышенной чувствительностью, т. е. сенсибилизацией у лиц с генетической предрасположенностью. При повторном попадании аллергена в организм образуются специфические белки — антитела класса IgE с особыми биологическими свойствами, которые фиксируются на поверхности тучных клеток шоковых органов и повреждают их. В результате происходит выброс в кровь гистамина и других биологически активных веществ, которые и обусловливают клиническую картину болезни. При пищевой сенсибилизации шоковыми органами чаще всего становятся кожа и желудочно-кишечный тракт. Реже наблюдаются симптомы респираторной аллергии.
Распространенность пищевой аллергии, обусловленной аллергическими реакциями немедленного типа (IgE-опосредованные), составляет, по данным разных авторов, 0,1–7%. Мужчины болеют в 2 раза чаще, чем женщины.
Пищевая аллергия развивается вследствие отсутствия толерантности или ее утраты. Высокую частоту заболевания в детском возрасте, в том числе у грудных детей, можно объяснить функциональной незрелостью иммунной системы и органов пищеварения. В ЖКТ у детей продуцируется небольшое количество IgA. Важное значение местного иммунитета подтверждает тот факт, что у детей с дефицитом IgA пищевая аллергия встречается чаще. Кроме того, в желудке ребенка по сравнению со взрослыми вырабатывается меньше соляной кислоты, ниже активность пищеварительных ферментов и продукция слизи, липопротеиды слизи отличаются по химическому составу и физическим свойствам. Все это способствует формированию пищевой непереносимости у лиц с генетической предрасположенностью.
Развитие пищевой гиперчувствительности, связанное со сложным процессом пищеварения, носит мультифакториальный характер.
Псевдоаллергические реакции. Псевдоаллергические реакции часто наблюдаются при патологии ЖКТ. В связи с нарушением слизистой оболочки кишечника, которое приводит к большей, чем обычно, доступности тучных клеток для экзогенных гистаминолибераторов, например земляники, рыбы, пищевых добавок, могут возникать реакции, клинически напоминающие аллергические, но при обследовании уровень аллергических антител класса IgE оказывается в пределах нормы. Наблюдается готовность многочисленных тучных клеток, диффузно рассеянных по слизистой оболочке ЖКТ и, по-видимому, за его пределами, отвечать на неспецифические раздражители выбросом биологически активных веществ. Этим объясняется частое появление рецидивирующей крапивницы, отеков Квинке при отсутствии четкого аллергологического анамнеза, на фоне заболеваний ЖКТ.
Псевдоаллергические реакции наблюдаются при снижении активности гистаминазы, т. е. при нарушении механизмов дезактивации биологически активных веществ.
Часто отмечаются реакции на продукты, содержащие большое количество гистамина. Например, тунец содержит 400 мг гистамина на 100 г продукта. Большое количество гистамина имеется в красном вине.
Пивные дрожжи, маринованная селедка богаты тирамином. У пациента может наблюдаться инициированная тирамином тошнота, рвота, головная боль. Избыточное количество тирамина образуется в кишечнике при нарушении микробного биоценоза.
Нередко непереносимость пищи псевдоаллергического характера вызывается такими пищевыми добавками, как оранжевый краситель тартразин (он находится в газированных напитках, креме, мармеладе и других продуктах). Возникающие осложнения связаны с нарушением метаболизма арахидоновой кислоты и образованием простагландинов, вызывающих приступы удушья.
Непереносимость пищи, связанная с дефицитом ферментов. Выделяют следующие варианты непереносимости пищи как результата дефицита пищеварительных ферментов.
- Непереносимость коровьего молока, обусловленная врожденным или приобретенным дефицитом лактазы, разлагающей молочный сахар — лактозу (чаще наблюдается среди населения Африки и Азии). Клинически отмечается вздутие живота, диарея.
- Реже встречается дефицит сахаразы, нарушающий ферментацию сахара и проявляющийся диареей (в кале много сахара, имеется кислая рH-среда).
При синдроме целиакии (malabsorbtion) имеется дефицит ферментов, необходимых для ферментации и всасывания глютена — белка, содержащегося в зернах пшеницы, риса и других зерновых культурах. Клиника заболевания выражается в поносах. При исключении злаков, содержащих глютен, состояние нормализуется. В тяжелых случаях при биопсии определяется атрофия кишечных ворсинок. В крови находят антитела класса IgG к глиадину, который является компонентом глютена.
Непереносимость пищи, обусловленная психическими заболеваниями. Психогенная непереносимость пищи встречается довольно часто. Больные предъявляют жалобы на чувство дискомфорта, головную боль, слабость, тошноту, рвоту, начинают избегать приема многих продуктов. При исключении жизнеобеспечивающих продуктов может развиваться железодефицитная анемия, наблюдаться снижение уровня белка в крови. Нервная анорексия (изменение пищевого поведения) может наблюдаться в комплексе с нарушением адаптации, диссоциативных (истерических), тревожных и депрессивных расстройств и требует консультации психиатра.
Пищевая аллергия имеет разнообразную клиническую картину. Могут наблюдаться желудочно-кишечные проявления (тошнота, рвота, боли в животе, понос), т. е. клиника аллергического гастрита, энтероколита. Специфическим действием пептических гормонов, продуцируемых апудоцитами желудка и двенадцатиперстной кишки, можно объяснить появление некоторых клинических симптомов пищевой аллергии после провокации продуктом-аллергеном: усиление моторики, морфологические изменения в слизистой оболочке желудка и кишечника, гиперемия и кровоизлияния в слизистой оболочке.
Отдельной нозологической формой является эозинофильный гастрит, энтероколит. Заболевание протекает без участия IgE-опосредованных механизмов.
У части больных имеются явления хейлита, стоматита. Могут наблюдаться крапивница, отек Квинке, обострение атопического дерматита, а также респираторные жалобы (ринит, приступы удушья).
Чаще всего пищевую аллергию вызывают яйца, коровье молоко, арахис, лесные орехи, моллюски, ракообразные, пшеница, кукуруза.
Диагностика пищевой аллергии
Диагностика пищевой аллергии основывается на основании жалоб пациента, анамнеза, данных осмотра, результатов лабораторных исследований.
Необходимо установить связь между приемом определенного продукта и появлением жалоб. Врач должен уточнить характер поражения ЖКТ, кожи, органов дыхания и определить степень тяжести заболевания.
Обращают внимание на семейный и личный аллергологический анамнез.
При осмотре необходимо уточнить вес и рост пациента и сравнить эти показатели с возрастными нормами. На коже могут быть разнообразные высыпания. Оценивается состояние подкожной клетчатки.
При аллергическом рините носовое дыхание может быть затруднено. При обострении бронхиальной астмы больного беспокоит кашель, свистящее дыхание, что диагностируется при осмотре больного. Данная группа пациентов нуждается в проведении классического пульмонологического обследования, включающего рентгенологическое исследование органов грудной клетки, микроскопический анализ мокроты, исследование функции внешнего дыхания.
К серьезным аллергическим осложнениям относится отек гортани. При осмотре гортани ЛОР-врач обнаруживает отек подсвязочного пространства.
У пациента имеется осиплость голоса, при выраженном отеке (II, III степени) появляется затруднение дыхания.
При наличии гастроэнтерологических жалоб и проведении рентгенологического исследования выявляется картина пилороспазма, повышенного тонуса и ускоренного пассажа бария в тонкой кишке, сегментарного отека слизистой оболочки, которые исчезают после непродолжительного периода лечения антигистаминами.
Эзофагогастродуоденоскопия позволяет исключить другие причины поражения ЖКТ и оценить степень повреждения слизистой оболочки.
Лабораторные исследования дают большую информацию у больных, страдающих пищевой аллергией. В анализе крови выявляется эозинофилия. Повышение уровня общего IgE при отсутствии гельминтоза свидетельствует об атопическом заболевании.
Важным этапом аллергологического обследования является определение специфических IgE-антител. Проводится радиоаллергосорбентный тест (наиболее информативный). Можно использовать MAST, иммуноферментный анализ.
К достижениям современной лабораторной диагностики относится определение чувствительности организма к различным аллергенам по восьми тестам. Это эксклюзивное исследование проводится в Институте аллергологии и клинической иммунологии.
Примером могут служить результаты лабораторной диагностики, представленные в таблице, по которым было сделано заключение: сенсибилизация по IgE-зависимому типу, псевдоаллергические реакции.
Дальнейшим этапом работы с пациентом является проведение кожного тестирования, которое проводится не ранее месяца после исчезновения аллергических жалоб. Надежность кожных проб зависит от типа аллергена. При аллергии к коровьему молоку, яйцам, рыбе, орехам, сое пробы обычно положительны. Если результаты кожных проб с готовыми экстрактами не соответствуют данным анамнеза, делают пробы со свежеприготовленными экстрактами.
Внутрикожные пробы с готовыми препаратами пищевых аллергенов не применяются, так как при них часто наблюдаются ложноположительные реакции. Кроме того, при внутрикожном введении некоторых аллергенов, например аллергенов орехов, могут развиться тяжелые анафилактические реакции.
Пациенту рекомендуется ведение пищевого дневника, в котором он отмечает употребляемые продукты и регистрирует возникшие осложнения. Для диагностики пищевой аллергии и выявления аллергенов часто применяются элиминационные диеты. Элиминационная проба заключается в исключении на 7–14 дней продуктов, которые могут служить причиной аллергической реакции. Если «подозреваемых» продуктов несколько, пробу можно повторить, последовательно исключая определенные продукты. Данный метод эффективен при хронических аллергических заболеваниях, например атопическом дерматите. Элиминационные пробы весьма утомительны как для врачей, так и для пациентов и требуют больших затрат времени. Кроме того, постоянная элиминация пищевых продуктов может привести к неполноценному питанию, что сказывается на состоянии здоровья детей. В редких случаях для подтверждения этиологической значимости прибегают к сочетанию пищевого элиминационного и провокационного тестов.
Наиболее достоверную информацию дают провокационные пищевые пробы двойным слепым методом.
Представленная схема проведения провокационных пищевых проб предложена Boch и соавторами (J. Clin. Allergy Immunol. 62:327,1978).
- За 2 нед до провокационной пробы назначают элиминационную диету, исключая из рациона предполагаемые аллергены.
- Для проведения проб используют сухие продукты (порошковое молоко, яичный порошок, пшеничную муку). При необходимости лиофилизируют и измельчают сырые продукты.
- Продукты помещают в непрозрачные бесцветные капсулы. Ни врач, ни пациент не знают о том, какие продукты находятся в капсулах. Начальная доза продукта — 20–2000 мг в зависимости от тяжести пищевой аллергии. Капсулы дают больному перед едой.
- Детям младшего возраста, которые не могут проглотить капсулы, исследуемые продукты подмешиваются к еде.
- При аллергических реакциях немедленного типа симптомы появляются в течение 2 ч. При отсутствии реакции в течение 24 ч дозу продукта ежедневно повышают в 2 раза и доводят до 8000 мг. Это количество сухого продукта соответствует приблизительно 100 г исходного продукта.
- При сомнительных результатах провокационных проб больному назначают глюкозу в капсулах.
- При развитии аллергической реакции провокационную пробу считают положительной. При отсутствии реакции на прием 8000 мг сухого продукта проба является отрицательной.
- При системных аллергических реакциях на продукты в анамнезе провокационные пробы проводить опасно в связи с возможностью развития анафилактических реакций.
Продукты питания растительного происхождения, чаще всего вызывающие пищевую аллергию
Злаки: пшеница: пшеничная мука грубого помола, пшеничная мука с высоким содержанием клейковины; отруби; проростки пшеницы; рожь; ячмень: солод; кукуруза: кукурузный крахмал, кукурузное масло, кукурузный сахар, кукурузный сироп; овес; рис: канадский рис; сорго; тростник: тростниковый сахар, черная патока.
Розоцветные: яблоко: сидр, уксус, яблочный пектин; вишня; груша; айва: семена айвы; слива: чернослив; малина; ежевика; логанова ягода; гибрид черной смородины и ежевики; клубника; земляника; персик; абрикос; нектарин; миндаль.
Гречишные: гречиха; ревень.
Пасленовые: картофель; томаты; баклажаны; красный перец; кайенский перец; зеленый перец; чилийский перец.
Сложноцветные: салат; салатный цикорий; артишок; одуванчик; овсяный корень; цикорий; подсолнечник: подсолнечное масло; земляная груша.
Бобовые: фасоль обыкновенная; фасоль лима; стручковая фасоль; соевые бобы: соевое масло; чечевица; вигна китайская; горох; арахис: арахисовое масло; лакрица; акация; сенна.
Зонтичные: петрушка; пастернак; морковь; сельдерей; тмин; анис; укроп; кориандр; фенхель.
Марантовые: маранта.
Крестоцветные: горчица; капуста кочанная; капуста цветная; брокколи; капуста брюссельская; репа; брюква; капуста китайская; кольраби; редька; хрен; кресс водяной.
Тыквенные: тыква обыкновенная; тыква крупноплодная; огурец; мускусная дыня; белая мускусная дыня; персидская дыня; зимняя дыня; арбуз.
Лилейные: спаржа; лук; чеснок; лук-порей; шнит-лук; алоэ.
Маревые: свекла: свекловичный сахар; шпинат; листовая свекла.
Вьюнковые: батат; ямс.
Гранатовые: гранат.
Эбеновые: хурма.
Крыжовниковые: крыжовник; смородина.
Молочайные: маниока; тапиока.
Бромелиевые: ананас.
Кариковые: папайя.
Виноградовые: виноград: изюм; винный камень.
Миртовые: гвоздика; душистый перец; гуайява; пимента.
Губоцветные: мята перечная; мята колосовая; тимьян; шалфей; майоран; чабер.
Перцевые: черный перец.
Чайные: чай.
Кунжутовые: семена кунжута: кунжутное масло.
Ореховые: орех американский; орех грецкий; орех черный; орех серый; орех гикори; орех пекан.
Аронниковые: таро.
Банановые: банан.
Лавровые: авокадо; коричник; лавр.
Маслиновые: оливки; маслины: оливковое масло.
Мускатниковые: мускатный орех.
Имбирные: имбирь; кардамон; куркума.
Кипарисовые: можжевельник.
Орхидные: ваниль.
Мареновые: кофе.
Буковые: бук; каштан.
Анакардиевые: анакардиум (орехи кешью); манго; фисташки.
Пальмы: кокос; финик; саговая пальма.
Маковые: мак.
Вересковые: клюква; голубика; черника; брусника.
Жимолостные: бузина.
Рутовые: апельсин; грейпфрут; лимон; лайм; мандарин; кинкан.
Березовые: фундук; лещина; гаультерия.
Тутовые: шелковица; инжир; хлебное дерево.
Коноплевые: хмель.
Кленовые: кленовый сироп; кленовый сахар.
Стеркулиевые: какао; шоколад.
Мальвовые: бамия; хлопок (семена).
Грибы: дрожжевые; шампиньоны.
Продукты питания животного происхождения, чаще всего вызывающие пищевую аллергию
Ракообразные (класс). Крабы. Лангусты. Омары. Креветки.
Пресмыкающие (класс). Черепаха.
Млекопитающие (класс). Быки: телятина, коровье молоко, сливочное масло, сыр, желатин. Кабаны: ветчина, бекон. Козлы: козье молоко, сыр. Бараны: баранина. Оленевые. Лошадиные. Зайцевые. Беличьи.
Птицы (класс). Утиные: утки, утиные яйца. Гуси: гусиные яйца. Голубиные: голуби. Куриные: куры, куриные яйца. Цесарки. Индейки. Фазаны. Куропатки. Тетерева.
Рыбы (надкласс). Осетровые: осетровая икра. Анчоусы. Сардины. Сельди. Алозы. Корюшковые. Лососевые (форель). Сиговые. Голавль. Угревые. Карповые. Чукучановые (иктиобус). Сомовые. Подкаменщики. Щуковые. Кефалевые. Барракудовые. Скумбриевые (тунцы, пеламиды). Маслюковые. Меч-рыба. Морские языки. Окуневые (речной и морской окуни). Луциановые. Горбылевые (горбыли, серебристые горбыли). Морские караси. Камбаловые (камбала, палтус). Скорпеновые (морской окунь). Тресковые (пикша, сайда, манек). Мерлузовые (хеки).
Моллюски (тип). Морские ушки. Мидии. Устрицы. Гребешки. Клемы. Кальмары.
Земноводные (класс). Лягушки.
Основные пищевые аллергены
Почти все пищевые продукты, кроме соли и сахара, обладают той или иной степенью антигенности.
Наиболее часто аллергические реакции на пищевые продукты вызывают гликопротеины с молекулярной массой от 10 000 до 67 000. Они хорошо растворимы в воде, обычно термостабильны, устойчивы к воздействию кислот и протеолитических ферментов.
В США проводились исследования с применением провокационного теста с плацебо и показано, что в 93% случаев пищевая аллергия обусловлена восемью пищевыми продуктами. В порядке убывания аллергенной значимости их можно расположить следующим образом: яйца, арахис, молоко, соя, лесные орехи, рыба, ракообразные, пшеница. Кроме того, доказано, что аллергическая активность шоколада значительно преувеличена.
Анафилактические реакции со смертельным исходом у взрослых и детей старшего возраста наблюдались от арахиса, ракообразных, лесных орехов, рыбы. Среди факторов, повышающих вероятность летального исхода, отмечается наличие сопутствующей бронхиальной астмы и запоздалое введение адреналина.
Особенно важна проблема пищевой аллергии у маленьких детей, у которых в связи с высокой проницаемостью кишечной стенки, недостаточностью ферментов и попаданием непереваренных белков в кровоток пищевая аллергия встречается намного чаще, чем у взрослых.
Коровье молоко. Оно содержит 20 белков. Наибольшей аллергенностью обладает β-лактоглобулин. Кроме того, молоко содержит казеин (слабый антиген), a-лактальбумин (a-Lа), альбумин бычьей сыворотки (АБС) и др. При кипячении АБС и α-Lа разрушаются через 15–20 мин и больные, чувствительные к этим фракциям, могут безболезненно употреблять молоко после обработки. Сгущенное и сухое молоко содержат все антигенные белки молока и потому исключаются при сенсибилизации к белкам коровьего молока, которые в этом случае заменяется козьим. В сыре содержится казеин, немного α-Lа, поэтому некоторые пациенты с аллергией к молоку могут нормально переносить сыр.
Молоко входит в состав многих продуктов (некоторые сорта хлеба, мороженое, шоколад, кремы и др.).
Яйца курицы. Антигенные свойства протеинов белка и желтка различны, а при термической обработке антигенность белка снижается. Протеины белка не видоспецифичны, поэтому замена утиными, гусиными яйцами невозможна. Аллергия к куриному яйцу сочетается с аллергией к мясу курицы. У пациентов может иметь место непереносимость продуктов, содержащих яйца. Яйца входят в состав сдобных сортов хлеба, тортов, конфет, мороженого и других продуктов. Необходимо отметить, что культуры вирусов и риккетсий выращиваются на курином эмбрионе и готовые вакцины содержат примесь белков яйца. При вакцинации от гриппа, сыпного тифа, желтой лихорадки могут наблюдаться тяжелые анафилактические реакции вплоть до летального исхода у чувствительных пациентов.
Рыба обладает выраженными аллергенными свойствами. При высокой степени чувствительности клинические проявления могут наблюдаться также при вдыхании паров рыбы во время варки, аэрозолей при механической обработке. Больные в этом случае отмечают непереносимость всех видов рыбы. Зачастую аллергия к рыбе, т. е. ее саркоплазматическим белкам, сохраняется пожизненно. Кулинарная обработка снижает аллергенность данного продукта, и пациенты могут нормально переносить рыбные консервы.
Аллергены рыб меняют свои свойства при липофильной сушке. В связи с тем, что этот процесс часто применяют при приготовлении пищевых аллергенов, это следует иметь в виду при получении отрицательных результатов провокационного теста с аллергенами из рыбы.
Ракообразные (раки, крабы, креветки, омары). У ракообразных имеется резко выраженная перекрестная антигенность, т. е. при непереносимости одного вида необходимо элиминировать из диеты и остальные.
Мясо. Антигенный состав животных различен, поэтому при аллергии к говядине можно употреблять баранину, свинину, птицу. У больных с аллергией к конине повышается чувствительность к лошадиной сыворотке, и им нельзя вводить противостолбнячную сыворотку.
Пищевые злаки (пшеница, рожь, кукуруза, рис, пшено, овес и др.). Эти злаки редко вызывают аллергию. Тяжелые реакции иногда наблюдаются на гречиху. При сенсибилизации к злаковым следует помнить о том, что пшеничная мука входит в состав многих сортов колбас, сосисок. Рисовая и пшеничная мука могут применяться в некоторых косметических средствах, например пудре.
Овощи, фрукты, ягоды. Аллергические проявления нередко наблюдаются при употреблении фруктов и ягод. Больные, страдающие аллергией к пыльце деревьев, часто не переносят яблоки, косточковые фрукты. При термальной обработке антигенность овощей, фруктов и ягод снижается.
На прием к аллергологу обращаются пациенты с жалобами на появление зуда в полости рта, отека губ, крапивницы, реже — симптомов ринита, кашля, бронхоспазма, т. е. респираторных явлений, после употребления «классических» пищевых аллергенов: клубники, земляники, цитрусовых.
Орехи. Они часто вызывают тяжелые аллергические реакции, причем на минимальные количества продукта. Больные, страдающие поллинозом с аллергией к пыльце орешника (лещины), часто не переносят орехи. Орехи широко применяются в кондитерской промышленности.
Приправы. Они могут вызывать аллергию у больных, страдающих поллинозом.
Аллергия на молоко, яйца и сою, встречающаяся у детей раннего возраста, в большинстве случаев спонтанно исчезает ко 2–3-му году жизни. При термической обработке аллергенные свойства пищи могут снижаться.
При дифференциальном диагнозе аллергических и псевдоаллергических реакций следует обратить внимание на следующие признаки.
- Истинные аллергические реакции на пищу обычно начинаются в детстве.
- При аллергическом характере заболевания отмечается высокая эозинофилия крови и может быть значительная эозинофилия в слизи фекалий.
- При атопии выявляются специфические антитела в крови и положительные кожные пробы с пищевыми аллергенами.
Лечение пищевой аллергии
Родителям больного ребенка или взрослому пациенту, у которого в прошлом были тяжелые системные аллергические реакции на продукты, врач должен объяснить, что употребление этих продуктов очень опасно и может привести к смерти. При питании вне дома необходимо всегда выяснять, какие продукты входят в состав предложенной пищи. В каждой школе должны иметься лекарственные средства для лечения тяжелых аллергических реакций. Детей старше 7 лет следует научить самостоятельным инъекциям адреналина. Учителя должны быть в курсе заболевания ребенка. Желательно не держать в доме аллергенные продукты. Если это невозможно, на них следует помещать предупреждающие этикетки.
Лечение пищевой аллергии начинается после верификации диагноза в результате аллергологического и общеклинического (в первую очередь гастроэнтерологического) обследования.
При тяжелых анафилактических реакциях «виновный» продукт, а также продукты с общей аллергенной детерминантой должны быть исключены из рациона пациента.
Прежде чем исключить молоко, следует попробовать заменить сырое молоко на кипяченое или коровье молоко на козье.
Часто необходима консультация диетолога для дачи рекомендаций по подбору продуктов, чтобы сохранить сбалансированность диеты по составу белков, жиров, углеводов, витаминов, микроэлементов. Калорийность пищи должна соответствовать энергетическим затратам пациента.
Иногда по истечении нескольких лет аллергия может исчезнуть (обычно это наблюдается через 2 года). Повторно вводить продукт в рацион следует осторожно.
Следует помнить, что аллергия к арахису, рыбе, ракообразным сохраняется на протяжении всей жизни.
Иногда наступает улучшение состояния при ограничении употребления аллергенного продукта.
Антигистаминные препараты. Н1-блокаторы применяются при пищевой аллергии, проявляющейся крапивницей, отеком Квинке, конъюнктивитом или ринитом, также при усилении кожного зуда у пациентов с атопическим дерматитом. Эффективность Н1-блокаторов при поражении ЖКТ не доказана. Антигистамины можно применять для профилактики легких аллергических реакций. Для этой цели больше подходят препараты, являющиеся стабилизаторами мембран тучных клеток (например, кетотифен).
Глюкокортикоиды. Препараты назначаются при тяжелых проявлениях аллергии, эозинофильном гастроэнтероколите. Курс лечения продолжается, как правило, от 3 до 14 дней.
Кромолин. Лекарство назначается для приема перед едой на длительный срок. Накоплен положительный опыт применения препарата как у взрослых, так и у детей.
Адреналин. Больные, имеющие в анамнезе анафилактоидные реакции, должны в личной аптечке иметь адреналин для оказания экстренной медицинской помощи.
Лечение анафилактического шока
Препаратом первой линии является адреналин. Он является физиологическим антагонистом гистамина, вызывает перераспределение объема циркулирующей крови и приток ее к жизненно важным органам.
При анафилактическом шоке вводится адреналин 0,1% — 0,3 мл подкожно, затем возможно повторное введение препарата каждые 15 мин (в общей сложности не более трех инъекций). За этот период необходимо наладить капельное введение допамина и поместить больного в реанимационное отделение для проведения дальнейшего лечения.
Обязательно назначаются глюкокортикоиды — преднизолон 90 мг внутримышечно каждые 4–6 ч или дексаметазон 8 мг каждые 8 ч (суммарная суточная доза — 16–24 мг). Последние годы хорошо зарекомендовал себя целестон, обладающий большей длительностью действия и сохраняющий активность до 12 ч. Суммарная доза препарата зависит от веса пациента. Введение глюкокортикоидов при анафилактическом шоке проводится не менее 3 дней. При наличии висцеральных поражений, неврологических осложнений возможен более длительный курс лечения.
При наличии отека Квинке дополнительно вводится мочегонное средство, особенно если имеется отек гортани. Антигистаминные препараты при анафилактическом шоке недостаточно эффективны.
Лечение патологии желудочно-кишечного тракта
При наличии клинических проявлений основными принципами лечения имеющейся патологии ЖКТ являются:
- Подавление чрезмерного роста условно-патогенной флоры.
- Регуляция и стабилизация анаэробного и аэробного звеньев нормальной кишечной флоры.
- Оптимизация моторно-эвакуаторной функции.
- Удаление и абсорбция токсинов.
- Восстановление нарушенных видов обмена.
- Коррекция функции гуморального и клеточного звеньев иммунитета.
- Лечение сопутствующих патологий, прежде всего паразитарных заболеваний и хронических инфекций.
Назначается диетотерапия (в повседневный рацион включаются кисломолочные, бифидосодержащие продукты, лактосодержащие смеси). Назначаются препараты, способствующие восстановлению нормальной микрофлоры кишечника. Это прежде всего классические монокомпонентные препараты (колибактерин, бифидумбактерин, лактобактерин). При необходимости — препараты конкурентного действия, вытесняющие патогенную микрофлору (бактисубтил, интетрикс и др.). Есть поликомпонентные препараты нормофлоры (линекс, бифиформ и др.).
Нормальная микрофлора кишечника играет важную роль в поддержании метаболических процессов, а также резистентности организма по отношению к чужеродным веществам, прежде всего белковой природы. Кишечная микрофлора уменьшает токсическое воздействие на стенку кишечника патогенных бактерий, препятствует попаданию в кровоток токсинов, поступающих в организм с пищей. Выделяемые в процессе жизнедеятельности нормальной микрофлоры органические кислоты (молочная, уксусная, пропионовая и др.) подкисляют химус, препятствуют размножению патогенной флоры. Кишечная аутофлора синтезирует разные антибактериальные вещества.
Рекомендуется использование ферментных препаратов (панкреатин, панзинорм, мезим форте, энзистал и др.). Важна строгая привязанность препаратов к приему пищи, что дает синхронизацию моторики ЖКТ с секреторной активностью поджелудочной железы. Это благоприятно влияет на функцию пищеварения.
При необходимости подключаются препараты, влияющие на моторику ЖКТ (прокинетики), например мотилиум.
Своевременное и комплексное лечение способствует повышению эффективности терапии основного заболевания.
В заключение отметим, что пищевая аллергия относится к группе атопических заболеваний, при которых организм отвечает на пищевые антигены образованием реагинов — антител класса IgE, реже — IgG.
Антитела класса IgE фиксируются на тучных клетках, повреждают их. Происходит выброс биологически активных веществ, что обусловливает разнообразные клинические проявления болезни. Природа атопии комплексна, в ее развитии участвуют как генетические, так и внешнесредовые факторы. В основе атопии лежат нарушения иммунитета, при которых наблюдается дисбаланс между Th-1 и Th-2 клетками в сторону повышения активности последних, что и приводит к запуску аллергических механизмов.
Терапевтам, гастроэнтерологам необходимо хорошо представлять себе механизмы пищевой непереносимости, чтобы своевременно назначить адекватное лечение.
Ю. В. Сергеев, доктор медицинских наук, профессор
Т. П. Гусева
А. М. Пашкова
Институт аллергологии и клинической иммунологии, Москва
Реакции на ужаления насекомых

Реакции на укусы насекомых представляют собой болезненные состояния, развивающиеся вследствие чувствительности организма к компонентам яда или слюны, проникающим в организм при укусах. Они могут быть аллергическими и токсическими и в ряде случаев способны стать причиной летального исхода. От аллергий на укусы насекомых страдает каждый 10-ый житель нашей планеты; особенно опасным в этом плане является яд перепончатокрылых насекомых, способный инициировать развитие анафилаксии и привести к летальному исходу.
Пройти лечение реакции ребёнка или взрослого на укусы насекомых в Москве предлагает отделение аллергологии ЦЭЛТ. В нашей многопрофильной клинике работают ведущие отечественные специалисты, располагающие современной диагностической и лечебной базой и практикующие современные методики устранения аллергических и токсических реакций. Записаться к ним на приём можно онлайн или связавшись с нашими операторами: +7 (495) 788-33-88
Этиология реакций на укусы насекомых
Аллергические и токсические реакции вызваны непосредственно укусами и другими воздействиями различных насекомых. Перепончатокрылые протыкают кожный покров жалом и выпускают в образовавшуюся ранку яд, на что организм может соответствующе отреагировать. Так, укусы:
- комаров сопровождаются зудом и аллергической реакцией с отёками, сыпью, иногда – повышением температуры;
- блох являются причиной дематозов, повышения температуры тела, сыпи, похожей на кропивницу;
- клопов провоцируют различную реакцию, начиная от обычного зуда и заканчивая анафилактическим шоком;
- москитов являются причиной формирования зудящих папул, жжения кожи, тошноты, рвоты, вторичных высыпаний;
- слепней обуславливают местные отёки, покраснения, появление опухолей, отёки лимфатических узлов;
- мошек приводят к формированию папул, отёчности, развития гиперемии и тахикардии.
Виды реакций на укусы насекомых
Как уже упоминалось, выделяют аллергические и токсические реакции, развивающиеся вследствие укусов перепончатокрылых.
| Вид реакции | Чем проявлены? |
|---|---|
| Аллергические реакции на укус насекомых | Представлены четырьмя типами в зависимости от клинических проявлений: |
- Лёгкие общие реакции – сыпи, ощущение зуда и общее недомогание;
- Общие реакции – клиника лёгких реакций дополняется одышкой, болевой симптоматикой в животе, тошнотой и рвотой;
- Тяжёлые общие реакции – дополняют вышеперечисленное такими проявлениями, как асфиксия, нарушение акта глотания, хриплость, бессвязность мыслей;
- Шоковая реакция – в дополнение к вышеупомянутому появляются синюшная окраска кожи и слизистых, снижение артериального давления до критических показателей, потеря сознания.
- Развитие отёков;
- Появление головной боли;
- Рвота и нарушения стула в виде диареи;
- Повышение общей температуры тела;
- Судорожные мышечные сокращения;
- Коматозное состояние.
Симптоматика реакции на укусы насекомых
Специалисты выделяют три типа реакций на укусы перепончатокрылых:
- Обычные – поражённая область опухает, краснеет, чешется и болит;
- Большие местные – диаметр опухоли превышает 50 мм;
- Системные – реакции возникают не только в области укуса, но и в частях тела, удалённых от него.
Местная реакция на кожном покрове может длиться от двух-трёх часов до нескольких дней, а может – и до 24-ёх месяцев. В этом случае важно дифференцировать реакцию на укус от новообразования добро- или злокачественной природы. Стоит отметить, что симптоматика реакций весьма разнообразна и варьируется в диапазоне от небольших болевых ощущений до анафилактического шока. Что касается местных реакций, то и здесь картина похожа: от небольшой папулы до отёка поражённой руки или ноги.
Диагностика реакции на укусы насекомых
Главная задача аллерголога, который ставит диагноз – провести полноценный сбор анамнеза, который позволит установить следующее:
- Ранее отмечаемые реакции на укусы насекомых;
- Наличие факта укуса перепончатокрылыми;
- Какое именно насекомое укусило пациента.
Кроме того, проводится осмотр, а также дополнительные диагностические исследования, направленные на выявление реакции в виде нарушения работы систем и внутренних органов. Они могут заключаться в следующем:
- Ультразвуковое сканирование органов брюшины;
- Электрокардиография;
- Аллергические пробы.
Наши врачи


Лечение реакций на укусы насекомых
Тактика лечения подбирается индивидуально, на основании результатов диагностики и показаний пациента. Местные кожные реакции не требуют пребывания в стационаре, чего не скажешь о серьёзных системных реакциях. Первое, чему уделяют внимание, – устранение аллергена из организма, сведение к минимуму его всасывания в кровь.
В случае, если в ранке виднеется жало, его удаляют и накладывают жгут на область выше укуса или, если это невозможно, прикладывают холод, который сузит кровеносные сосуды и исключит быстрое распространение яда по организму. Если насекомое укусило в руку или ногу, их приподнимают с той же целью.
Медикаментозное лечение направлено на приём антигистаминов, глюкокортикостеродов и других групп фармакологических препаратов, позволяющих нормализовать работу организма. При наличии показаний пострадавшему проводят аллерген-специфическую иммунотерапию. Она заключается во введении в организм аллергена в постепенно увеличивающихся дозировках. Благодаря этому при последующем укусе реакция будет минимальной или не появится вовсе.
Аллергологи ЦЭЛТ рекомендуют своевременно обращаться к специалистам при реакциях на укусы насекомых. Такой подход позволяет исключить развитие осложнений в виде нарушения работы внутренних органов и систем. У нас работают врачи высшей категории с опытом от 35-ти лет, которые знают, как облегчить реакции на укусы насекомых!
Пройдите диагностику и лечение аллергических и токсических реакций на укусы насекомых в ЦЭЛТ!
Источники:
- https://www.lvrach.ru/partners/nutr_pediatr/15435323
- https://medcentr-endomedlab.ru/allergologija/jepitelij_krolika.html
- https://stolichki.ru/stati/pischevaya-allergiya
- https://www.lvrach.ru/2001/10/4529083
- https://www.lvrach.ru/2006/04/4533713
- https://www.celt.ru/napravlenija/allergologija/zabolevanija/reaction-yzhaleniya-nasekomih/


.jpg)