Причины, механизм развития, виды, симптомы и методы диагностики диабетической полинейропатии. Индивидуальный подход к выбору препаратов для лечения диабетической полинейропатии в клинике неврологии Юсуповской больницы. Лечение полинейропатии при сахарном диабете.
Гастроинтестинальные проявления пищевой аллергии у детей Рассмотрены атопические и эозинофильные заболевания пищеварительного тракта — гастроинтестинальная гиперчувствительность, оральный
Причины, симптомы, стадии и диагностика псориатического артрита. Как лечить воспаление суставов: клинические рекомендации, таблетки, операция. Чем опасен псориатический артрит.
Что такое муковисцидоз (кистозный фиброз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кольцова Е. В., пульмонолога со стажем в 7 лет.
Псориатический артрит
В последнее время во всем мире отмечается тенденция к раннему появлению суставных симптомов и быстрому прогрессирующему течению псориатического артрита с последующей инвалидизацией. Современная медицина может приостановить прогрессирование болезни, поэтому так важно вовремя обращаться за медицинской помощью. Клиника «Парамита» в Москве окажет помощь пациентам на любой стадии заболевания.
Общие сведения
Псориатический артрит (ПсА) или псориатическая артропатия – это хроническое системное заболевание костно-суставной системы, ассоциированное с псориазом, то есть, сопутствующее ему. Коды по международной классификации болезней 10-го пересмотра (МКБ-10) — L 40.5, M07.0 — M07.3.
По данным статистики заболеваемость ПсА составляет 3 – 8 на 100000 населения. Воспалительные процессы в суставах при псориазе чаще появляются у людей на фоне уже имеющихся кожных высыпаний (70% от всех заболевших). Но бывает и наоборот, когда псориатический артрит является единственным проявлением заболевания, что значительно осложняет своевременную диагностику. Таких больных около 15%, у стольких же заболевших имели место одновременно кожные и суставные симптомы.
Почему и как развивается болезнь
Причины развития псориаза полностью не установлены. Считается, что в развитии псориатического артрита основная роль отводится иммунной системе и наследственной предрасположенности. Установлено, что около 40% больных ПсА имеют близких родственников, страдающих псориазом.
Под действием каких-либо пусковых факторов-триггеров (нервного стресса, инфекции, переохлаждения, злоупотребления спиртным и др.) у генетически предрасположенных лиц происходит сбой в работе иммунной системы. В норме иммунные клетки вырабатывают информационные молекулы – цитокины, регулирующие воспалительные реакции. Сбой в работе иммунитета приводит тому, что нормальное соотношение цитокинов, поддерживающих и подавляющих воспаление, нарушается, развивается цитокиновый шторм, и воспаление приобретает неконтролируемый характер.
Генетическая предрасположенность проявляется в наличии в организме определенных антигенов. Так, при наличии антигена В38 псориатический артрит быстро прогрессирует с развитием деструктивного процесса, разрушающего суставную поверхность. Наличие антигенов В17 и Cw6 говорит о возможном вовлечении в процесс небольшого количества суставов, а антигена В57 — множественного поражения.
Патогенез заболевания связан с выработкой к антигенам антител. Комплексы антиген-антитело откладываются в синовиальной оболочке, вызывая воспалительный процесс, который длительное время поддерживается при помощи цитокинового шторма. Продолжительно протекающий псориатический артрит разрушает хрящевую ткань, вызывает разрежение костной ткани (остеопороз) и ее разрастание с развитием деформации сустава, его неподвижности (анкилоза) и утратой функции.
Клинические формы псориатического артрита
Выделяют следующие варианты ПсА:
- Дистальный. В патологический процесс вовлекаются конечные суставы пальцев. Встречается в 5% случаев.
- Асимметричное поражение одного или нескольких (не более четырех) крупных суставов, а также проксимальных (расположенных ближе к конечности) суставов пальцев. Встречается у двух третей пациентов.
- Симметричное поражение (ревматоидоподобная форма) встречается у пятой части пациентов.
- Остеолитический. Проявляется растворением (лизисом) костной суставной ткани с уменьшением длины и подвывихами пальцев. Появление остеолиза возможно при всех формах псориатического артрита.
- Спондилоартритический. Поражаются крестцово-подвздошные суставы и суставы позвоночника. Встречается в половине случаев. Сочетание с псориатическим артритом суставов конечностей развивается гораздо реже.
Симптомы псориатического артрита
Признаки псориатического артрита зависят от характера его течения.
Первые признаки
Псориатический артрит начинается в среднем через 6 лет после появления изменений на кожных покровах. Но в последние годы все чаще ПсА предшествует кожным высыпаниям.
Заболевание обычно начинается с появления лихорадки, недомогания, покраснения и отека дистальных межфаланговых суставчиков пальцев рук и ног с развитием редискообразной деформации кончиков пальцев. Поражение сразу нескольких межфаланговых суставчиков пальца с вовлечением в процесс мягких тканей носит название дактилита (воспаления пальца). Палец опухает, приобретает красновато-синюшный цвет и внешне напоминает сосиску. Все это сопровождается сильными болями.

Отек, покраснение сустава и лихорадка — первые признаки псориатического артрита
Гораздо реже первые симптомы псориатического артрита появляются в одном-двух крупных суставах. Поражения асимметричные, чаще всего поражаются голеностопы, а затем воспаление поднимается как по лестнице с поражением колена. Характерна утренняя скованность движений, которая через некоторое время проходит. Реже происходит симметричное поражение крупных суставов, чаще всего, коленных – ревматоидоподобная форма.
При появлении первых симптомов псориатического артрита следует немедленно обращаться к врачу, чтобы как можно быстрее остановить прогрессирование заболевания.
Явные симптомы
К характерным признакам псориатического артрита относятся:
- дистальные поражения пальцев с одновременным поражением ногтей; развитие дактилитов с сосискообразными пальцами;
- асимметричное поражение 2 – 3 крупных суставов с формированием моно- и олигоартритов (поражений одного или нескольких суставов) и энтезитов (воспаления места прикрепления сухожилий); боли при псориатическом артрите усиливаются утром и уменьшаются после начала двигательной активности; особенно часто в патологический процесс вовлекаются суставы нижних конечностей (коленные, голеностопные); иногда воспаление распространяется на множественные сочленения;
- в процесс вовлекаются также суставы пояснично-крестцового отдела позвоночника и крестцово-подвздошные сочленения; это сопровождается болями и нарушениями движений: спина не разгибается;
- течение заболевания волнообразное: обострения чередуются с частичными (реже полными) ремиссиями; часто псориатический артрит обостряется на фоне прогрессирования кожных симптомов псориаза.
При появлении явных симптомов псориатического артрита еще не поздно обращаться за медицинской помощью: помочь пациенту можно в любом случае.
Опасные симптомы, рекомендации
К врачу нужно обращаться немедленно, если:
- воспаляется сразу множество суставов – признак генерализации процесса;
- появляются болевой синдром в пояснице — симптом псориатического артрита суставов позвоночника;
- появление суставных вывихов и подвывихов.
Эти симптомы псориатического артрита говорят о неблагоприятном течении заболевания и требуют немедленной медицинской помощи.
Чем опасен ПсА
Псориатический артрит протекает по-разному. Но даже незаметное течение может привести со временем к стойкой утрате трудоспособности. Чтобы выяснить степень опасности заболевания, нужно пройти обследование.
Степени псориатического артрита
В течении заболевания выделяют следующие степени активности:
- Незначительная. Проявляется небольшой болезненностью в пораженных суставах в период двигательной активности. Скованность движений утром после сна длится не более получаса или совсем отсутствует. Лихорадка отсутствует, лабораторные признаки воспалительного процесса минимальные: СОЭ не выше 20 мм/час.
- Средняя. Во время обострений появляется небольшая лихорадка, суставы могут слегка опухать, боли умеренные, появляются и в покое, и в движении. Скованность после сна держится до трех часов, проходит на фоне двигательной активности. Лабораторные показатели изменены значительно: СОЭ до 40 мм/час, повышенное количество лейкоцитов.
- Выраженная. Выраженная лихорадка во время обострения, суставы отекают, кожа над ними краснеет, боли очень сильные, постоянные. Скованность после сна держится больше трех часов. Лабораторные показатели сигнализируют о наличии тяжелой воспалительной реакции.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Возможные осложнения
Нелеченный псориатический артрит может прогрессировать и приводить к полной утрате суставной функции и инвалидности. Во время обострения в некоторых случаях возникают следующие осложнения:
- возникновение суставных подвывихов и вывихов;
- расплавление (лизис) дистальных концов костей пальцев кисти и стопы;
- генерализация процесса — тяжелое прогрессирующее течение с множественным поражением суставов;
- анкилоз — полная утрата суставной функции, нарушение подвижности конечности.
Что делать во время обострения псориатического артрита
При обострении, сопровождающемся высокой температурой, отеком, покраснением, суставными болями, необходимо выполнить следующие рекомендации:
- принять внутрь таблетку лекарства из группы нестероидных противовоспалительных препаратов (НПВП) – Найз, Диклофенак, Мелоксикам, Целебрекс;
- наносить несколько раз в день на больные суставы гель или крем с этими же средствами;
- для уменьшения отека можно принять антигистаминное средство – Кларитин, Зодак и др.;
- вызвать врача на дом.
При обострении заболевания можно принять противовоспалительные средства Найз, Диклофенак, Мелоксикам, Целебрекс, а также антигистаминное средство Кларитин или Зодак
Возможные локализации воспалительного процесса
Псориатический артрит может поражать разные суставы:
- Артрит нижних конечностей – самая частая локализация. Поражаются суставы:
- тазобедренный – редкая локализация, проявляется болями и скованностью движений; отечность и покраснение не характерны;
- коленный – из крупных суставных сочленений поражается чаще всего; поражения часто асимметричны и появляются или сразу в одном колене, или развиваются после первичного псориатического артрита суставов стопы (признак лестницы); – очень часто поражение начинается именно с него; выраженные воспаление и отек сопровождается сильными болями и нарушением движений;
- пятка – в области пятки при артрите голеностопа развивается энтезит – воспаление на внутреннем участке прикрепления к пяточной кости ахиллова сухожилия и подошвенного апоневроза; появляется небольшая припухлость и сильные боли в области пятки;
- межфаланговые суставчики – могут поражаться в первую очередь сразу несколько на одном или нескольких пальцах; развивается дактилит – воспаление пальца, и он приобретает вид сосиски; характерно также поражение конечных отделов пальцев и ногтей.
- Артрит верхних конечностей – встречается также часто. Поражаются суставы:
- плечевой – частая локализация; иногда это единственный пораженных сустав; отек, покраснение, болезненность и утренняя скованность зависят от степени активности патологического процесса;
- локтевой – чаще поражается после мелких суставчиков кисти (симптом лестницы);в области локтя часто развиваются энтезиты, усиливающие болезненность;
- мелкие суставчики кисти и пальцев – псориатический артрит суставов пальцев поражает сразу несколько их на одном пальце, и они приобретают вид сосисок; поражаются также дистальные концы пальцев и ногтевые пластины;.
- Пояснично-крестцовый артрит – поражаются суставы пояснично-крестцового отдела позвоночника. Появляются боли в пояснице и в области ягодиц, нарушается функция позвоночника – сгибание и разгибание сначала невозможно из-за боли, а затем из-за развития анкилоза.
- Крестцово-подвздошный артрит – развивается достаточно часто, имеет асимметричный характер, проявляется болями в одной стороне спины, отдающими в паховую область.
Все об артрите и его симптомах читайте тут.
Как установить правильный диагноз?
Для диагностики псориатического артрита часто используют УЗИ и рентгенографику
Диагностика псориатического артрита проводится по данным анамнеза (опроса пациента) и характерных признаков заболевания. Подтверждается диагноз лабораторными и инструментальными исследованиями:
- Лабораторные. Проводятся анализы крови – общеклинические, биохимические, генетические – выявляют признаки воспалительного процесса, наличие или отсутствие ревматоидного фактора (для исключения ревматоидного артрита), антигены, поддерживающие воспалительный процесс.
- Инструментальная диагностика:
- рентгенография — кистей, стоп, таза, пояснично-крестцового отдела позвоночника и всех остальных заинтересованных суставов;
- УЗИ – определение объема суставной жидкости и энтезитов;
- МРТ – для раннего выявления суставных изменений позвоночника и крестцово-подвздошных сочленениях.
Лечение псориатического артрита
После установление окончательного диагноза проводится лечение псориатического артрита. Оно должно быть комплексным и подбираться для каждого больного индивидуально. Цель лечения:
- подавление активности воспаления и прогрессирования заболевания;
- предупреждение разрушения суставных сочленений и утраты им своей функции.
Полностью вылечить псориатический артрит невозможно. Но современная медицина располагает возможностями контроля и управления этим заболеванием при условии проведения лечения по назначению и под контролем лечащего врача. Значительное увеличение продолжительности ремиссии вполне реально.
Применяются медикаментозные и немедикаментозные методы лечения псориатического артрита. При необходимости используют народные средства и хирургические методы.
Энтеропатия с потерей белка

Здоровье каждой собаки очень сильно зависит от способности организма перерабатывать ту пищу, которая составляет её ежедневный рацион питания. Тем не менее, не редки ситуации, при которых пищеварительный процесс может быть нарушен. Одно из серьезных нарушений пищеварения – энтеропатия с потерей белка (ЭПБ).
Гипоальбуминемия как причина ЭБП
Снижение уровня альбумина (гипоальбуминемия) определяется такими симптомами, как хроническая диарея, рвота, потеря веса, увеличение живота в объеме, отёки конечностей. Также животное может страдать от одышки. После обнаружения у собаки гипоальбунемии, необходимо сразу же определить, насколько снижен синтез белка (печёночная недостаточность) или в какой степени происходит потеря белков (почечная недостаточность).
Потеря белков может происходить через почки, слизистую оболочку кишечника, при гнойном перитоните в тяжёлой стадии, гнойном плеврите или через кожу в результате сильных механических повреждений (например, ожогов).
Стандартные лабораторные анализы – анализ мочи, полный анализ крови, анализ желчных кислот, биохимический анализ крови – позволяют исключить из списка причин печёночную недостаточность или нефропатию с потерей белка.
Причины энтеропатии с потерей белка
Для того, чтобы ветеринарный врач подобрал верное лечение для собаки, необходимо выявить причину возникновения заболевания. К наиболее вероятным можно отнести сильное заражение кишечными паразитами, воспалительные заболевания кишечника, грибковые инфекции, проблемы с движением лимфатической жидкости из кишечника (вторичная лимфаэктазия), язвы желудка или кишечника.
Диагностика
Если на УЗИ выявлено утолщение стенок кишечника, необходимо провести пункционную биопсию повреждённых органов или лимфатических узлов. Данный метод позволяет исключить новообразование и поставить собаке окончательный диагноз ЭПБ. Если УЗИ брюшной полости покажет небольшие изменения или вообще отсутствие изменений, может быть показано эндоскопическое обследование. Внутренний осмотр желудка или кишечника позволяет увидеть язвы, опухоли или другие нарушения в структуре стенок. Кроме того, во время гастроскопии можно получить образцы тканей (биоптат).
Лечение
Лечение собаки будет напрямую зависеть от причины возникновения заболевания. Если уровень белка находится на угрожающе низком уровне, может потребоваться переливание крови или плазмы, чтобы восполнить дефицит. Препараты альбумина также могут быть использованы у животных.
низкого уровня белка животному необходимо подобрать специальную высокоуглеводную диету с пониженным содержанием жира и клетчатки. Для лучшей усвояемости рекомендуется питание маленькими порциями, но более часто.
В случае с хроническими проявлениями энтеропатии рекомендуют лечение коркистероидами (преднизолоном) или другими иммуносупрессивными препаратами (циклоспорином).
Дальнейшие меры
После того, как собака поправится, необходимо будет проводить ежемесячные наблюдения в ветеринарной клинике. Данные обследования позволяют убедиться в том, что уровень белка в организме животного является стабильным, в брюшной полости нет жидкости, а у собаки не возникает проблем с дыханием. Также специалисты смогут подобрать особую диету. При смене диеты необходимо проводить регулярные обследования у ветеринара во избежание рецидива.
Практика показывает, что при своевременном выявлении и начале лечения ЭПБ прогнозы будут благоприятными.
(с) Ветеринарный центр лечения и реабилитации животных «Зоостатус».
Варшавское шоссе, 125 стр.1. тел. 8 (499) 372-27-37
Энтеропатия с потерей белка: начало конца?
Кишечные потери белка являются признаком нарушения пищеварительной функции, нередко в результате тяжелых острых или хронических воспалительных поражений ЖКТ или вследствие нарушений всасывания желчи и кишечного лимфотока. Раннее распознавание синдрома и выявление его причины имеют важное значение. Необходим системный диагностический подход для исключения других причин гипопротеинемии и выявления основного кишечного заболевания. Значимая гипоальбуминемия (сывороточный альбумин
Задачи
Описать системный диагностический подход для подтверждения потери белка в кишечнике и определения причины проблемы.
Рассмотреть основные причины энтеропатии с потерей белка (ЭПБ) у собак.
Обеспечить обновленные варианты терапии и обсудить прогноз различных ЭПБ.
Введение
Потеря белка в кишечнике является признаком нарушения пищеварительной функции, которое может быть вызвано тяжелыми острыми или хроническими воспалительными поражениями или нарушений всасывания желчи и кишечного лимфотока. В то время как точные механизмы, приводящие к потере кишечного белка, не были установлены у собак, три основные причины ЭПБ, обоснованные у людей, вероятно, также применимы к собакам. Потеря белка может быть результатом: 1) эрозивного или язвенного поражения слизистой оболочки, вызывающие вторичную экссудацию белков; 2) лимфатическая дисфункция, приводящая к вытеканию лимфы, богатой протеином, в просвет кишечника; и/или 3) изменения слизистой оболочки, сопровождающиеся повреждением слизистого барьера с развитием аномальной проницаемости и потерей белка. (1)
Эта статья будет посвящена хроническим кишечным расстройствам, приводящим к потере белка в кишечнике. ЭПБ гораздо меньше распространена у кошек. У собак она часто представляет собой тяжелую хроническую идиопатическую воспалительную энтеропатию, ассоциированную с воспалительным заболеванием кишечника (ВЗК), или в сочетании с идиопатической лимфангиэктазией кишечника у конкретных пород.
Диагностический подход
У собак с ЭПБ часто отмечаются клинические признаки, характерные для хронической рецидивирующей тонкокишечной диареи с возможной рвотой. В тяжелых случаях может наблюдаться дизрексия/анорексия и питательная недостаточность с признаками мальабсорбции и потерей веса. Однако, выраженная кишечная потеря протеина и гипоальбуминемия могут также развиться без явных эпизодов диареи. У некоторых собак гипоальбуминемия нередко обнаруживается случайно во время регулярных плановых обследований. При наличии выраженной гипоальбуминемии (сывороточный альбумин
Первая диагностическая задача состоит в установлении причины потери белка. В связи с этим должны быть проведены минимальные диагностические исследования (общий клинический анализ крови, биохимический профиль сыворотки крови, общий анализ мочи). Необходимо исключить ренальную потерю белка (результаты анализа мочи, соотношение белок/креатинин в моче), а также нарушение функции печени (уровень постпрандиальных сывороточных желчных кислот — уровень желчных кислот после приема пищи). Кроме того, потеря белка может быть связана с поступлением белков в «третье» (интерстициальное) пространство (например, при васкулитах). Как правило, ЭПБ ассоциируется с гипопротеинемией из-за неселективной потери белка. Гипоальбуминемия с нормальной или повышенной концентрацией сывороточных глобулинов свидетельствует о потере белка вследствие нефропатии или, возможно, при дисфункции печени. Хотя эти эмпирические правила полезны при использовании на практике, на них не следует слепо полагаться, поскольку существует множество исключений. Так у собаки с выраженным системным воспалением (например, гистоплазмоз) может наблюдаться гипоальбуминемия и гиперглобулинемия. Другие общие отклонения у собак с ЭПБ включают гипохолестеринемию, гипокальциемию (полного и ионизированного), гипомагниемию и лимфопению.
После того, как была подтверждена потеря белка через желудочно-кишечный тракт, дальнейшее обследование должно включать УЗИ брюшной полости с акцентом на стенку кишечника, в частности толщину и слоистость стенок. Гиперэхогенные борозды в толще слизистой оболочки часто наблюдаются, а если быть точными, появляются, у собак с ЭПБ (Рис. 1). Есть предположение, что они могут представлять собой расширенные лимфатические микрососуды ворсинок слизистой кишечника, но также могут появляться вследствие расширения кишечных крипт, что часто отмечается при ЭПБ, но возможны и другие механизмы. Бороздки не следует путать с гиперэхогенной зернистостью слизистой оболочки, которая является неспецифическим признаком воспаления.
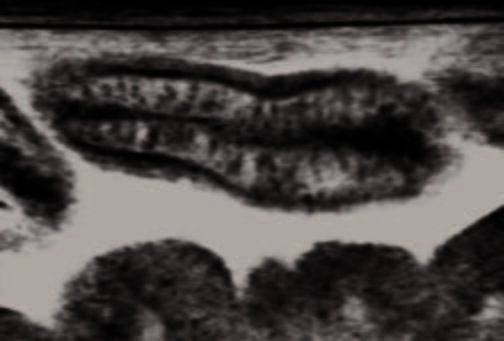
Рисунок 1. Отклонения при УЗ-исследовании 5-ти летнего кастрированного йоркширского терьера с лимфангиэктазией и поражением крипт. Отмечается присутствие свободного абдоминального выпота (асцит) между органами. Визуализируется кишечная петля в продольной проекции. Отмечается нарушение слоистости стенки кишечника, отмечаются гиперэхогенные бороздки, проходящие поперек гипоэхогенного слизистого слоя. Обнаружение таких бороздок достоверно свидетельствует о наличии ЭПБ у собак.
Однако окончательный диагноз зависит исключительно от результатов гистопатологического анализа материала, полученного при биопсии кишечника методом эндоскопии или диагностической лапаротомии. Собаки с тяжелой гипоальбуминемией являются плохими кандидатами на общую анестезию, и иногда предпочтительно избежать общего наркоза у таких животных, принимая во внимание чрезмерные анестезиологические риски, и отложить эндоскопию или операцию. Кроме того, многие собаки с ЭПБ имеют бикавитарный выпот (в брюшной и грудной полости), поэтому рекомендуется проведение рентгенографии грудной клетки в качестве скрининг-исследования на наличие грудного выпота, что может представлять дополнительный анестезиологический риск. Синтетические (гидроксиэтилированные крахмалы) и природные коллоиды (растворы альбумина плазмы человека или собаки) эффективны для быстрого повышения онкотического давления в критических случаях. Несмотря на риск анафилактической реакции или других осложнений, медленная инфузия 5% раствора человеческого альбумина в дозе 2 мл/кг/ч в течение 10 часов на протяжении суток (общий суточный объем 20 мл/кг/сут) носит результативный характер для частичного восстановления концентрации сывороточного альбумина с целью минимизации рисков общей анестезии. (3)
Выбор относительно более предпочтительного метода забора биопсии зависит от множества факторов, таких как наличие оборудования и хирургических или эндоскопических навыков ветеринарного специалиста. Преимущества хирургического исследования (диагностической лапаротомии) заключаются в возможности для забора проб из нескольких участков тонкого кишечника и получения образца во всю толщину стенки. Хирургическое иссечение биопсий кишечника проводить не рекомендуется, тем более, что эта процедура имеет большие риски у животных с гипоальбуминемией,(4) хотя в некоторых случаях может быть выполнена с осторожностью (с использованием серозных патчей). Эндоскопия является минимально инвазивным методом для получения биопсии, но ограничивается слизистой оболочкой, при этом для получения качественного образца необходимы хорошие эндоскопические навыки. Тем не менее, преимущество метода заключается в хорошей визуализации слизистой оболочки, что позволяет проводить целенаправленный отбор проб из пораженных участков слизистой (Рис. 2). (5) Согласно общепринятым методикам, обследовали только двенадцатиперстную кишку. Недавние исследования убедительно показали, что важное значение имеет забор биопсии как из двенадцатиперстной, так и подвздошной кишки, так как распределение поражений стенки может быть нерегулярным, а тяжелые поражения подвздошной кишки могут отмечаться у собаки с незначительными изменениями стенки двенадцатиперстной кишки или их отсутствием. (5) Эта дополнительная процедура по забору биопсии из подвздошной кишки может продлить время анестезии, так как она проводится посредством колоноскопии для интубирования подвздошной кишки или сбора биопсий слизистой оболочки, пропуская эндоскопические щипцы через илео-цекальный сфинктер. Однако, возможность более точной диагностики превышает недостатки этой длительной процедуры.
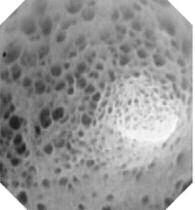
Рисунок 2. Внешний вид слизистой оболочки двенадцатиперстной кишки при эндоскопическом исследовании у стерилизованной 4-х летней самки йоркширского терьера с ЭПБ вследствие кишечной лимфангиэктазией. Множественные «папулы», которые предположительно представляют собой увеличенные ворсинки кишки в результате расширенных лимфатических капилляров.
Дифференциальный диагноз
Заболевания, наиболее часто сопровождающие ЭПБ, включают кишечные лимфангиэктазии, (1,6) ВЗК, (1,7) и хронические энтеропатии, характеризующиеся выраженными структурными изменениям слизистой оболочки, такие как дилатация крипт тонкого кишечника. (1,8) Кроме того, лимфома ЖК тракта, (9) и кишечный гистоплазмоз (10) нередко вызывают ЭПБ.
Кишечная лимфангиэктазия (КЛ): в исследованиях показано, что к первичной КЛ склонны следующие породы: йоркширские терьеры, китайские шарпеи, мальтийские болонки, норвежские лундехунды и ротвейлеры (в Европе). (1,6,11,12) Патогенез первичной КЛ до сих пор плохо изучен. Она развивается в результате затрудненного тока лимфы внутри кишечной стенки, который предположительно может быть вызван аномальным лимфангиогенезом лимфатической системы кишечника. Однако, приобретенная обструкция здорового лимфатического сосудистого русла, по-видимому, является более распространенной причиной появления гранулем, связанного с просачиванием лимфы, которая сдавливает кишечные лимфоузлы и/или кишечные лимфатические сосуды. Вторичная КЛ обычно ассоциируется с выраженным воспалением слизистой оболочки кишечника (например, ВЗК, грибковая инфекция) или неоплазией (лимфома ЖКТ). Гистопатологические изменения слизистой включают дилатацию лимфатических капилляров в ворсинках слизистой оболочки (Рис. 3) и наличие глубоко расположенных перилимфатических гранулем, это лучше видно на биоптатах, взятых через всю толщину стенки. Лимфатические капилляры имеют существенное значение для поглощения жиров, а их обструкция приводит к сильному расширению и разрыву. Из поврежденных лимфатических микрокапилляров содержимое, богатое жирами и белками, попадает в просвет кишечника.
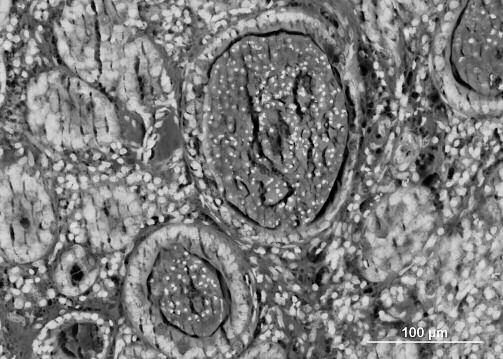
Рисунок 3. Та же собака, что и на рисунке 2. Гистологический срез биопсийного образца слизистой двенадцатиперстной кишки. Виден расширенный лимфатический капилляр, который привел к увеличению ворсинки (окраска гематоксилин-эозином).
Воспалительные заболевания кишечника (ВЗК): детальный обзор этой группы заболеваний выходит за рамки данного сообщения. Термин ВЗК описывает «группу хронических энтеропатий, характеризующихся персистирующими или рецидивирующими признаками желудочно-кишечного (ЖКТ) расстройства и воспаления ЖКТ. (7) Воспалительный процесс, локализующийся в слизистой оболочке ЖКТ, может привести к потере белка как вследствие снижения всасывания питательных веществ, так и нарушения целостности слизистого барьера кишечника с поступлением белков в просвет кишечника.
ЭПБ у мягкошерстных пшеничных терьеров является специфической формой ВЗК, поражающей эту породу во всем мире. При этом у 50% собак ЭПБ и почечная потеря белка (ППБ) развиваются одновременно. Поражения слизистой оболочки могут носить тяжелый характер и включают воспалительную инфильтрацию, расширенные лимфатических микрокапилляров и глубоко расположенный кишечный лимфангит. Пока до конца не изучен патогенез данных изменений, но установлено наличие реакций гиперчувствительности, в эпизодах, вызванных специфическими белками. (13,14)
Заболевание крипт: с тех пор, как Уиллард впервые сообщил о шести собаках с дилатацией крипт 12 лет назад, (8) расширение крипт и их некроз часто ассоциировались с ЭПБ. (12,15) Расширенные крипты — это структурные изменения слизистой оболочки, которые часто наблюдаются у собак с ВЗК И КЛ (Рис.4). Однако в некоторых случаях расширение крипт и абсцессы могут быть единственными поражениями слизистой, обнаруживаемые у собак с ЭПБ. В недавно проведенном исследовании на 58-ми собаках с хроническими энтеропатиями, группа авторов показала, что собаки с гистологически установленными абсцессами крипт тонкого кишечника, вероятно, в большей степени страдают гипоальбуминемией вследствие ЭПБ, чем собаки без подобных поражений слизистой, при этом у них отмечены изменения стенки кишечника при УЗ-исследовании, а также более тяжелые клинические симптомы.
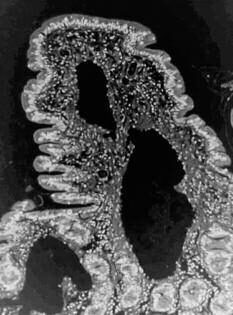
Рисунок 4. Гистопатологический срез двенадцатиперстной кишки собаки с ЭПБ. Отмечаются дебатированные крипты со слизью, клеточным мусором и нейтрофилами (абсцесс крипты). Любезно предоставлен д-ром N.Wakamatsu, LSU (окраска гематоксилин-эозином, 20х объектив).
Терапия
Двумя основными компонентами в лечении у собак с ЭПБ являются изменение рациона и контроль воспалительного процесса.
Диета: собаки с ЭПБ находятся в катаболическом состоянии, поэтому им необходимо адекватное питание. В настоящее время нет опубликованных исследований, критически оценивающих аспекты кормления собак с ЭПБ; однако имеется большой клинический опыт. У собак с первичной идиопатической КЛ изменение рациона базируется на кормление гастроинтестинальными диетами с низким или очень низким содержанием жира (10-15 % от сухого вещества) для предотвращения дальнейшего расширения и разрыва лимфатического микрокапилляра. Кроме того, рацион должен включать легко доступный диетический белок и иметь низкое содержание сырой клетчатки. В то время как лекарственная терапия может проводится в течение нескольких месяцев (см. ниже), а затем быть прекращена в некоторых случаях, диетическую терапию, вероятно, лучше сохранять на протяжении всей жизни собаки. У собак с ЭПБ вызванной ВЗК, многие ветеринарные врачи-гастроэнтерологи сообщают об успешном использовании в кормлении эксклюзивной диеты, на основе гидролизованных белков. Новые белковые диеты являются альтернативным подходом.
Поедание диеты является критической проблемой у собак с ЭПБ, особенно у тяжело больных животных с признаками анорексии. Для каждого пациента команда ветеринарных специалистов должна подобрать диету с хорошими вкусовыми качествами. У собак с тяжелыми формами ВЗК и ЭПБ диетическое питание может осуществляться через зонд, чтобы обеспечить организм необходимыми питательными веществами с минимальным риском рецидива болезни.
Контроль воспаления: у собак с первичным КЛ показана противовоспалительная глюкокортикоидная терапия (например, преднизолон в дозе 1 мг/кг/день), и часто необходима для купирования признаков воспаления. Его основной желаемый эффект заключается в уменьшении воспаления, которое связано со вторичным лимфогранулематозом вследствие экссудации лимфы, и в способности восстанавливать необходимый приток лимфы в кишечные лимфатические сосуды. У некоторых собак противовоспалительное лечение может быть постепенно отменено в течение двух-трех месяцев или дольше.
Иммуносупрессивная терапия: иммуносупрессия является основным звеном в лечении тяжелой ВЗК с ЭБП. Однако следует отменить, что хроническая иммуносупрессия может сделать животных более восприимчивыми к развитию тяжелых инфекций после контакта с патогенными или условно-патогенными микроорганизмами.
Первичный подход к назначению иммуносупрессивной терапии заключается в назначении преднизона или преднизолона , используя следующий протокол: начать с дозы 2 мг/кг каждые 12 часов от 3-х до 5-ти дней, затем уменьшить дозу до 2 мг/кг один раз в день до тех пор, пока состояние собаки значительно улучшиться, и животное станет стабильным. Впоследствии дозу можно уменьшать каждые 2 недели, сначала 1 мг/кг/день, затем 1 мг/кг через день и так далее. Однако, побочные эффекты стероидной терапии могут вызвать недовольство владельца.
Другие кортикостероиды. Будесонид приобрел популярность в лечении ВЗК собак. У людей известно местное действие данного стероида, и первичные превращения протекают при включении его в метаболизм печени. Поэтому системные осложнения, вызванные применением данного стероида, менее вероятны. У собак препарат значительно влияет на гипофизарно-надпочечниковую систему. 16 На сегодняшний день использование будесонида у собак или кошек с ВЗК не было глубоко изучено, и доступны только эпизодические сообщения. Кроме того, отсутствуют данные о фармакокинетике препарата, используемого перорально у домашних животных. Рекомендуемые дозы 0,5-3 мг/животное в день (в зависимости от размера собаки). Доза препарата должна быть рассчитана фармацевтом по инструкции для использования у маленьких собак. Одновременное применение с другими глюкокортикоидами не рекомендуется.
Азатиоприн близок к пуриновым основаниям, может быть использован у собак, страдающих ВЗК, но рефрактерных к стериодам, и в тех случаях, когда рецидивы не прекращаются после лечения преднизолоном. Азатиоприн также может быть совмещен с преднизолоном при первичном подходе к лечению тяжелых случаев ВЗК. Азатиоприн обычно хорошо переносится, но обладает побочными эффектами, включающими угнетение костного мозга, гепатотоксичность и панкреатит. Регулярное проведение общего клинического анализа крови и биохимии крови в течение первых недель или месяцев лечения. Начальная доза составляет 2 мг/кг ежедневно в течение трех недель, затем 1-2 мг/кг каждые 48 ч. Для достижения максимального эффекта может потребоваться до трех недель лечения.
Циклоспорин является ингибитором функции Т-клеток. В исследовании 2006 года, фармакокинетика циклоспорина у собак с ВЗК значимо не отличалась от таковой у здоровых животных. 14 собак со стероид-рефрактерным ВЗК были включены в опытную группу, и у 8-ми собак (57%) отметили развитии полной ремиссии не позднее чем через 4 недели после начала применения циклоспорина (5 мг/кг PO 1 раз в день). Кроме того, у трех собак отмечалась частичная ремиссия, в то время как две собаки не отреагировали на терапию и были подвергнуты эутаназии. Кроме того, у одной собаки наблюдался рецидив через 14 недель, несмотря на успешное лечение при первичном подходе. Кратковременные побочные эффекты были отмечены в течение первых двух недель лечения у пяти собак, и включали рвоту и потерю аппетита у четырех собак, и изменения качества шерсти и гиперплазию десен у одной собаки. Большинство побочных эффектов прекращались после временной отмены приема препарата с последующим возобновлением курса, только в более низкой дозировке. Лечение циклоспорином было прекращено у восьми из 11 собак, ответивших на терапию циклоспорином, при этом впоследствии рецидив клинических признаков ВЗК у этих животных не отмечался. Владельцы других трех собак решили продолжить лечение самостоятельно в течение несколько месяцев, и у этих собак, вероятно, отмечалось клиническое улучшение. (18) Вопрос, проводить ли мониторинг уровня циклоспорина в цельной крови или плазме является спорным. У собак появление регулярной рвоты через 1-2 часа после перорального приема препарата, возможно связано с тем, что пик концентрации циклоспорина в сыворотки крови достигает токсических уровней, поэтому разделение суточной дозы на несколько приемов может быть полезным.
Другие иммуносупрессивные препараты, такие как микофенолат мофетил, метотрексат и лефлуномид , были использованы при иммуноопосредованных или аутоиммунных заболеваниях у собак. Из-за отсутствия данных исследований и возможные побочные эффекты на слизистую оболочку кишечника, их использование для лечения ВЗК у собак в настоящее время не рекомендуется.
Осложнения
Гипокобаламинемия: Низкий уровень концентрации сывороточного кобаламина (витамина B12), как правило, отмечается у собак с ЭПБ, особенно развившейся вследствие ВЗК. Дефицит витамина В12 оказывает отрицательно влияние на промежуточный метаболизм и может задерживать нормальное заживление воспалительных повреждений кишечника. Купирование гипокобаламинемии у собак изначально проводили с применением еженедельных подкожных инъекций витамина В12 (от 250 до 1500 мкг/собаку) в течение шести недель. Если лечение оказывает положительный эффект, интервал между инъекциями может быть увеличен до двух недель курсом еще на шесть недель.
Гиперкоагуляция: последние исследования с использованием метода тромбоэластографии выявили высокую распространенность гиперкоагуляции у собак с ЭПБ, (19) которая значительно увеличивает риск тромбоэмболии с летальным исходом. Проблема может быть усугублена протромботическими эффектам глюкокортикоидов, которые часто используются для лечения ЭПБ. Интересно, что риск гиперкоагуляции не исчезает после успешного лечения ЭПБ, и это явление поднимает вопросы относительно патогенеза данного осложнений. У собак с подтвержденный гиперкоагуляцией введение низких доз аспирина (0,5-1 мг/кг/сут) и/или клопидогреля (1-5 мг/кг/сут) следует назначать, чтобы профилактировать тромбоэмболию. Однако, в настоящее время нет исследований, подтверждающих эффективное влияние этих препаратов.
Гипокальциемия: значительное снижение общего кальция предполагается у собак с умеренной и тяжелой гипоальбуминемией, так как 50% общего кальция связывается с альбумином. Однако, ионизированный кальций также может быть аномально низким у собак с ЭПБ. (20, 21) Низкая концентрация ионизированного кальция в сыворотке крови отмечалась в сочетании с низким уровнем 25-гидроксивитамина D и возрастанием уровня паратиреоидного гормона, что установлено в недавних исследованиях, проведенных у собак с ЭПБ. Авторы исследования предположили, что гиповитаминоз D был обусловлен кишечными потерями, а не мальабсорбцией, так как контрольная группа собак с ВЗК без ЭПБ имела нормальные уровни 25-гидроксивитамина D, и концентрация 25-гидроксивитамина D в сыворотке крови коррелировала с концентрацией сывороточного альбумина. (21) Коррекция гипокальциемии средней или тяжелой степени проводится путем парентерального введения 10% раствора кальция глюконата (например, 1 мл/кг медленно внутривенно в течение не менее 15-30 минут), также может назначаться раствор кальция хлорида после его разведения в соотношении 1:1 с 0,9% раствором натрия хлорида в максимальной суточного дозе до 9 мл/кг (вводится трех-четырехкратно), витамин D целесообразно применять для профилактики развития клинических признаков гиповитаминоза.
Прогноз
Идиопатическая лимфангиэктазия кишечника: Согласно предварительным данным
из нескольких исследований, установлена высокая смертность среди йоркширских терьеров с ЛК (50-60%). (25, 26) Тем не менее, результаты исследований на группе из 27 собак с ЭПБ из Великобритании показали, что у собак с ЭПБ в сочетании с расширением лимфатических микрокапилляров ворсинок отмечался более благоприятный исход болезни. (17) По мнению автора и из его опыта, значительная часть йоркширских терьеров с ЛК хорошо отвечает либо исключительно на строгую диету, либо в сочетании с глюкокортикостероидами в противовоспалительных дозах. Процент рефрактерных животных, по-видимому, варьируется в зависимости от географической принадлежности исследуемой группы. К сожалению, нет никаких известных параметров, которые позволяют провести выделение собак, невосприимчивых к диетическому и стероидному лечению. Так как было бы эффективно начинать раннее агрессивное лечение в тяжелых случаях ЛК.
Заболевание крипт: в серии исследований на 58 собаках с хроническими энтеропатиями группа авторов обнаружила наличие абсцессов крипт тонкого кишечника, что ассоциировалось со значительным снижением сроков выживаемости. (a)
Сноски
а Stroda K, Wakamatsu N, Kearney M. and Gaschen F., неопубликованные исследования (2012).
Автор перевода: Наталья Анисимова — ветеринарный врач-терапевт, кардиолог, врач визуальной диагностики, кандидат ветеринарных наук, СВК Свой Доктор, Москва.
Список литературы
1. Dossin O. Protein-losing enteropathies. Vet Clin N Amer Small Anim. 2011;41(2):399-418.
2. Gaschen L, Kircher P, Stussi A, et al. Comparison of ultrasonographic findings with clinical activity index (CIBDAI) and diagnosis in dogs with chronic enteropathies. Vet RadiolUltrasound. 2008;49(1):56-64.
3. Vigano F, Perissinotto L, Bosco VR. Administration of 5% human serum albumin in critically ill small animal patients with hypoalbuminemia: 418 dogs and 170 cats (1994-2008). J Vet Emerg Crit Car. 2010;20(2):237-243.
4. Shales CJ, Warren J, Anderson DM, et al. Complications following full-thickness small intestinal biopsy in 66 dogs: a retrospective study. The Journal of Small Animal Practice. 2005;46(7):317-321.
5. Casamian-Sorrosal D, Willard MD, Murray JK, et al. Comparison of histopathologic findings in biopsies from the duodenum and ileum of dogs with enteropathy. J Vet Intern Med. 2010;24(1):80-83.
6. Melzer KJ, Sellon RK. Canine intestinal lymphangiectasia. Compendium on Continuing Education for the Practicing Veterinarian. 2002;24(12):953-961.
7. Simpson KW, Jergens A. Pitfalls and progress in the diagnosis and management of canine inflammatory bowel disease. Vet Clin N Amer Small Anim. 2011;41(2):381-398.
8. Willard MD, Helman G, Fradkin JM, et al. Intestinal crypt lesions associated with protein-losing enteropathy in the dog. J Vet Intern Med. 2000;14(3):298-307.
9. Gieger T. Alimentary lymphoma in cats and dogs. The Veterinary Clinics of North America Small Animal Practice. 2011;41(2):419-432.
10. Bromel C, Greene CE. Histoplasmosis. In: Greene CE, ed. Infectious Diseases of the Dog and Cat. Elsevier Saunders, St. Louis, MO. 2012;4:614-621.
11. Kull PA, Hess RS, Craig LE, et al. Clinical, clinicopathologic, radiographic, and ultrasonographic characteristics of intestinal lymphangiectasia in dogs: 17 cases (1996-1998). J Am Vet Med Assoc. 2001;219(2):197-202.
12. Lecoindre P, Chevallier M, Guerret S. [Protein-losing enter — opathy of non neoplastic origin in the dog: a retrospective study of 34 cases]. Schweiz Arch Tierheilkd. 2010;152(3):141-146.
13. Littman MP, Dambach DM, Vaden SL, et al. Familial proteinlosing enteropathy and protein-losing nephropathy in Soft Coated Wheaten Terriers: 222 cases (1983-1997). J Vet Intern Med. 2000; 14(1):68-80.
14. Vaden SL, Hammerberg B, Davenport DJ, et al. Food hypersensitivity reactions in Soft Coated Wheaten Terriers with proteinlosing enteropathy or protein-losing nephropathy or both: gastroscopic food sensitivity testing, dietary provocation, and fecal immunoglobulin E J Vet Intern Med. 2000;14(1):60-67.
15. Willard MD, Zenger E, Mansell JL. Protein-losing enteropathy associated with cystic mucoid changes in the intestinal crypts of two dogs. J Am Anim Hosp Assoc. 2003;39(2):187-191.
16. Tumulty JW, Broussard JD, Steiner JM, et al. Clinical effects of short-term oral budesonide on the hypothalamic-pituitaryadrenal axis in dogs with inflammatory bowel disease. J of the Am Animal Hospital Association. 2004;40(2):120-123.
17. Dandrieux JR, Noble PJ, German A. Should chlorambucilprednisolone combination therapy be used in preference to azathioprine-prednisolone for the treatment of chronic enter — opathies with concurrent protein-losing enteropathy? ECVIMCA Congress. Seville, Spain. 2011.
18. Allenspach K, Rufenacht S, Sauter S, et al. Pharmacokinetics and clinical efficacy of cyclosporine treatment of dogs with steroid-refractory inflammatory bowel disease. J Vet Intern Med. 2006;20(2):239-244.
19. Goodwin LV, Goggs R, Chan DL, et al. Hypercoagulability in dogs with protein-losing enteropathy. J Vet Intern Med. 2011; 25(2):273-277.
20. Kimmel SE, Waddell LS, Michel KE. Hypomagnesemia and hypocalcemia associated with protein-losing enteropathy in York — shire terriers: five cases (1992-1998). J Am Vet Med Assoc. 2000; 217(5):703-706.
21. Gow AG, Else R, Evans H, et al. Hypovitaminosis D in dogs with inflammatory bowel disease and hypoalbuminaemia. The Journal of Small Animal Practice. 2011;52(8):411-418.
22. Craven M, Simpson JW, Ridyard AE, et al. Canine inflammatory bowel disease: retrospective analysis of diagnosis and outcome in 80 cases (1995-2002). J Small Anim Pract. 2004;45(7):336-342.
23. Allenspach K, Wieland B, Grone A, et al. Chronic enteropathies in dogs: evaluation of risk factors for negative outcome. J Vet Intern Med. 2007;21(4):700-708.
24. Owens SL, Parnell NK, Moore GE. Canine protein-losing enteropathy: a retrospective analysis and survival study in 68 dogs. ACVIM Forum. Denver. 2011.
25. Craven M, Duhamel GE, Sutter NB, et al. Absence of a bacterial association in Yorkshire Terriers with protein-losing enter — opathy and cystic intestinal crypts. ACVIM Forum. Montreal, Canada. 2009.
26. Simmerson SM, Wunschmann A, Crews L, et al. Description of protein-losing enteropathy in Yorkshire terrier dogs using the WSAVA gastrointestinal classification system. ACVIM Forum. Montreal, Canada. 2009.
Муковисцидоз (кистозный фиброз) — симптомы и лечение
Что такое муковисцидоз (кистозный фиброз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кольцовы Елены Владимировны, пульмонолога со стажем в 7 лет.
Над статьей доктора Кольцовы Елены Владимировны работали литературный редактор Вера Васина , научный редактор Елена Лобова и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Муковисцидоз — это наследственное заболевание, при котором нарушаются функции желёз внешней секреции. Болезнь поражает весь организм, но сильнее всего страдает дыхательная система и поджелудочная железа.
Заболевание также называется кистозным фиброзом, синдромом Фанкони. Характеризуется системным поражением экзокринных желез: слизеообразующих (респираторных, кишечника, поджелудочной) и серозных (слюнных, потовых, слезных).
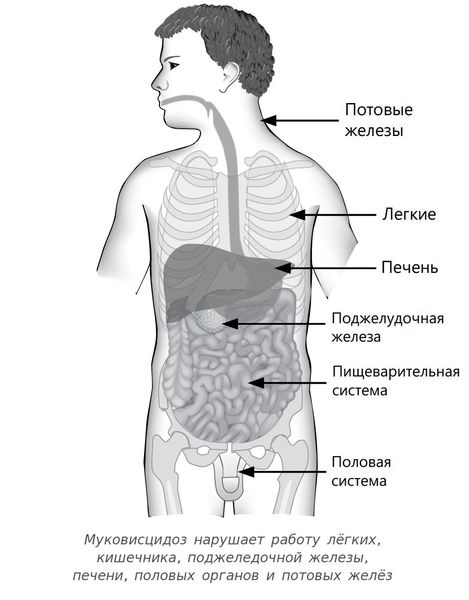
Частота болезни в России составляет 1:10000 новорождённых [1] . В 10-15 % случаев симптомы муковисцидоза проявляются у ребёнка с первых дней жизни. У таких детей возникает мекониальный илеус, или непроходимость кишечника, при котором его просвет закупорен слишком густым и вязким первородным калом — меконием.
В некоторых случаях симптомы болезни проявляются не сразу. Это связано с тем, что тяжесть и форма заболевания у разных больных отличаются. Кроме того, признаки муковисцидоза могут напоминать симптомы других болезней, что затрудняет диагностику. Без лечения подавляющее большинство больных умирает в детском возрасте, но благодаря современным лекарственным препаратам и другим методам лечения продолжительность жизни пациентов постоянно растёт.
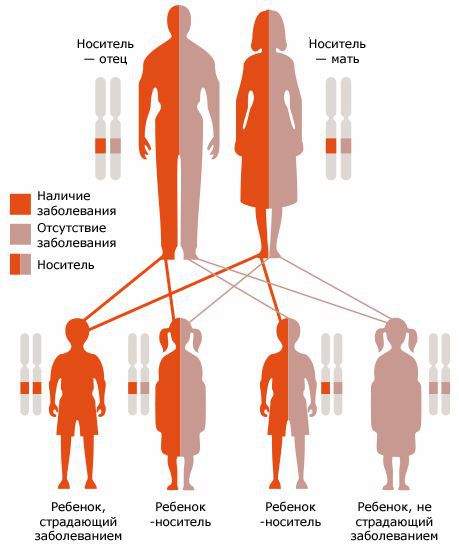
Муковисцидоз — это аутосомно-рецессивное заболевание, то есть болезнь проявляется в том случае, если «дефектный» ген унаследован от обоих родителей . Для этого и отец, и мать должны быть носителями мутации, вероятность рождения больного ребёнка у них составляет 25 % [7] .
Дефектный ген муковисцидоза широко распространен — каждый 25-й житель Северной Европы является гетерозиготным носителем мутантного гена. Высокая смертность в сочетании с повышенной фертильностью должны были бы привести к быстром устранению дефектного гена из популяции. Существует теория, по которой ген муковисцдоза сохранился потому, что его носители имели преимущество во время эпидемии холеры — холерная диарея сопровождается потерей натрия и хлора, а при муковисцидозе эти ионы удерживаются в организме [15] .
Чаще всего без адекватного лечения болезнь протекает тяжело и имеет плохой прогноз, на который во многом влияет развитие хронической инфекции в нижних дыхательных путях. Бактериальные агенты при муковисцидозе специфичны, например, для раннего возраста характерно развитие инфекции, вызванной золотистым стафилококком, в дальнейшем к нему присоединяются синегнойная и гемофильная палочки. Данные возбудители устойчивы к лекарственным препаратам, что осложняет лечение, поэтому важно своевременно идентифицировать возбудителя и подобрать подходящие антибактериальные средства.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы муковисцидоза
При муковисцидозе симптомы болезни зачастую видны сразу после рождения ребёнка и проявляются признаками непроходимости кишечника (мекониальным илеусом):
- выраженное беспокойство и постоянный плач;
- сильное вздутие живота;
- рвота;
- повышенное слюноотделение;
- длительная задержка стула;
- повышенная температура тела;
- частые поносы;
- непереносимость жирной пищи;
- характерный стул — вязкий, липкий, жирный.
Непроходимость кишечника может привести к его перфорации. По статистике, до 70-80 % детей с мекониальным илеусом больны муковисцидозом [3] . Для его исключения каждому новорождённому с кишечной непроходимостью необходимо провести диагностическое обследование.
В возрасте одного года у ребёнка с муковисцидозом может наблюдаться обильный, зловонный стул непереваренной пищей, частый сухой кашель, отставание в физическом развитии и длительная желтуха.
Одним из главных признаков муковисцидоза является повышенная солёность пота. Её замечают родители, когда при усиленном потоотделении на коже ребёнка выделяются крошечные кристаллы соли. Они образуются вследствие повышенной концентрации в потовой жидкости ионов натрия и хлора. Их концентрация увеличивается в результате нарушения транспорта и секреции в клетках, выстилающих потовые железы. При этом потери соли из организма при потоотделении могут превышать её поступление с пищей. При болезни, протекающей с высокой температурой и значительной потерей с потом хлора и натрия, может возникнуть токсикоз и шок [7] .
Иногда признаки заболевания проявляются только в школьном возрасте. Дети с муковисцидозом из-за нехватки питательных веществ страдают дефицитом массы тела и отстают в росте.
Для заболевания также характерны:
- изменение стула;
- хроническая диарея;
- вздутие кишечника;
- частые гнойные заболевания лёгких неясной этиологии;
- одышка;
- гаймориты и синуситы.
У заболевших в раннем детстве и доживших до взрослого возраста отмечаются постоянный сухой кашель, вне обострения чаще наблюдается постоянное отделение мокроты от 5-10 мл до 200 мл и более. Характер мокроты — от слизистой до гнойной. О дышка, которая в начале болезни может возникать только при небольшой нагрузке, но со временем усиливается, частые респираторные заболевания и гаймориты. У пациентов выражена задержка роста, фаланги пальцев и ногти изменяются по типу «барабанных палочек» и «часовых стёкол».
Грудная клетка чаще бочкообразной формы. Появляется бледность, одутловатость лица и цианоз видимых слизистых.
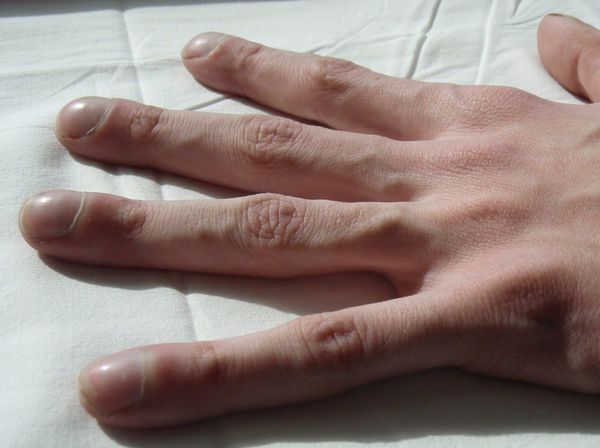
У больных может наблюдаться задержка в половом развитии или отсутствие вторичных половых признаков:
- отсутствие волос в подмышечных впадинах и на лобке;
- замедленный рост половых органов;
- недоразвитие молочных желёз у девочек;
- отсутствие менструального цикла.
У женщин с муковисцидозом снижена фертильность, у мужчин наблюдается азооспермия — отсутствие сперматозоидов в эякуляте [3] [4] .
Патогенез муковисцидоза
Патогенез муковисцидоза обусловлен мутацией гена CFTR (Cystic Fibrosis Transmembrane conductance Regulator) — муковисцидозного трансмембранного регулятора проводимости. Этот ген кодирует белок, который обеспечивает транспорт солей и воды в эпителиальном слое бронхолёгочной системы и в клетках, выстилающих железы, вырабатывающие секрет и выводящие его во внешнюю среду организма. Из-за дефекта структуры белка нарушается перемещение ионов натрия и хлора в клетках, что в итоге приводит к повышенной вязкости секрета экзокринных желез. Происходит увеличение всасывания ионов натрия и дефект секреции хлора, что ведёт к снижению или прекращению выделения жидкости в просвет бронхов. Из-за этого мокрота теряет свою жидкую часть, становится вязкой и густой. Впоследствии это ведёт к тому, что бронхи забиваются вязким секретом.
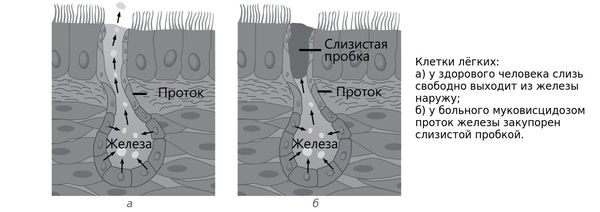
Таким образом, при муковисцидозе нарушаются функции желёз, которые вырабатывают пот, слизь, слёзы, слюну и пищеварительные соки. Через протоки этих желёз выделения выходят на поверхность тела или в полые органы, такие как кишечник или дыхательные пути. У пациентов с муковисцидозом в этих органах возникают серьёзные изменения, особенно они затрагивают бронхолёгочную систему — в язкий секрет закупоривает мелкие дыхательные пути.
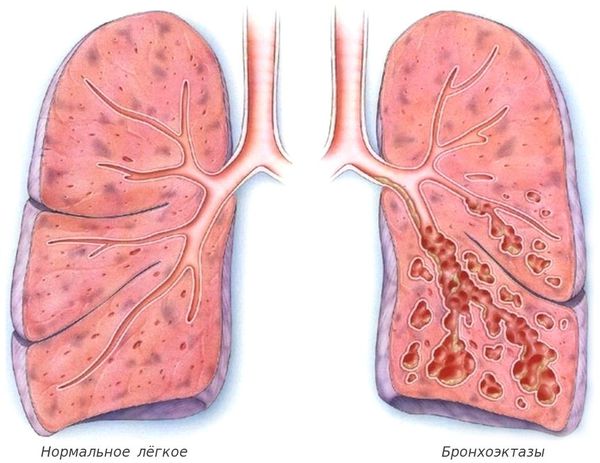
С лизь, выделяемая в дыхательных путях, необходима для удаления из них пыли и бактерий, но при муковисцидозе выработка и структура бронхиального секрета нарушаются. В результате на стенках дыхательных путей развивается хроническое воспаление, которое впоследствии приводит к формированию бронхоэктазов (расширения и деструкции бронхов) и рубцов в лёгочной ткани.
При муковисцидозе страдает не только дренажная функция дыхательных путей, но и клеточный и гуморальный иммунитет. Это происходит из-за нарушений в работе клеток и затруднённого движения ресничек мерцательного эпителия бронхов.
Помимо этого, при муковисцидозе ферменты, вырабатываемые поджелудочной железой, не поступают в кишечник. Они начинают разрушать ткань поджелудочной железы, в результате чего в ней формируются рубцы и кисты. Также необратимо нарушается весь процесс пищеварения. Это приводит к недостаточности массы тела, отставанию в росте и весе, хронической диарее и выпадению прямой кишки.
При муковисцидозе у мужчин отмечается обструкция (непроходимость) семявыносящих протоков, отсюда и высокий процент мужского бесплодия при заболевании.
Классификация и стадии развития муковисцидоза
В зависимости от преобладающих симптомов выделяют три основные клинические формы заболевания: кишечную, бронхолёгочную и смешанную.
Кишечная форма муковисцидоза. Кистозный фиброз с кишечными проявлениями Е84.1 (код по МКБ-10)
Из-за неправильной секреции ферментов нарушается работа органов желудочно-кишечного тракта. Ухудшается расщепление жиров, белков и углеводов, а также их усвоение. Не вся пища переваривается, стул становится обильным, частым и зловонным.
Отмечается вздутие, повышенное газообразование и боли в различных областях живота. Даже при хорошем аппетите дети теряют вес, отстают в росте и развитии. Кишечная форма выявляется у 5—10 % больных муковисцидозом [7] .
Бронхолёгочная форма муковисцидоза. Кистозный фиброз с лёгочными проявлениями Е84.0
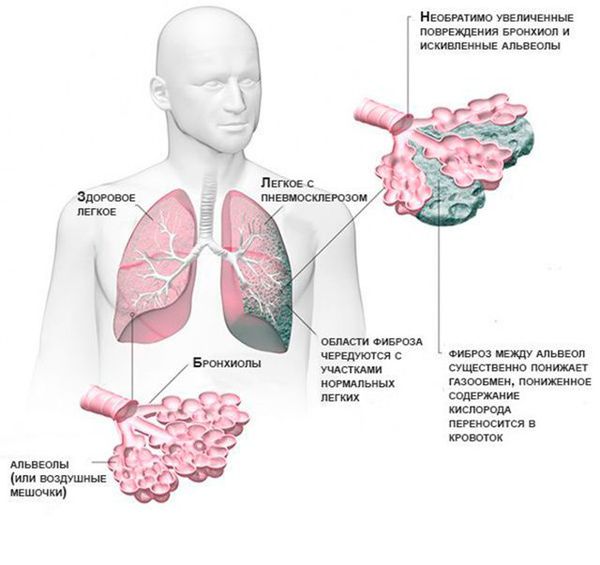
Нарушения затрагивают всю бронхолёгочную систему. Вязкая мокрота скапливается в дыхательных путях и её тяжело откашлять. При инфицировании золотистым стафилококком, синегнойной и гемофильной палочками возникают тяжёлые бронхиты и пневмонии, для которых характерно осложнённое течение с развитием одышки, интоксикации и выраженной слабостью. Со временем развиваются следующие необратимые изменения:
- деформация грудной клетки;
- расширение дистальных отделов бронхов (бронхоэктазы);
- замещение лёгочной ткани соединительной рубцовой (пневмосклероз);
- «лёгочное сердце» — из-за повышенного давления в малом круге кровообращения происходит увеличение правых отделов сердца.
Бронхолёгочная форма характерна для 15—20 % случаев муковисцидоза [7] .
Смешанная форма (лёгочно-кишечная)
Включает проявления лёгочной и кишечной форм. Это самый распространённый тип (65—75 % от всех случаев) и, как правило, самый тяжёлый [7] .
Различают четыре стадии развития муковисцидоза:
1. Непостоянство симптомов, пациент жалуется на частый сухой кашель и небольшую одышку при физических нагрузках. Стадия может длиться до 10 лет.
2. Кашель с отделением мокроты, одышка появляется в покое и усиливается при физической нагрузке, фаланги пальцев и ногтевые пластины деформируются по типу «барабанных палочек» и «часовых стёкол». Стадия продолжается от 2 до 15 лет.
3. Бронхолёгочные симптомы прогрессируют, развиваются тяжёлые осложнения. У пациентов усиливается одышка и появляются признаки сердечной недостаточности: отёки на ногах, одышка при небольшой активности или в покое, быстрая утомляемость, непереносимость физических нагрузок. На УЗИ сердца видны признаки гипертрофии левых и правых отделов, а также снижение сердечной фракции выброса левого желудочка. На рентгенологических снимках можно обнаружить зоны пневмофиброза, бронхоэктазы и кисты. Формируется сердечная недостаточность по правожелудочковому типу, так называемое «лёгочное сердце». Длительность стадии от 3 до 5 лет.
4. Тяжёлая кардио-респираторная недостаточность. Из-за дисфункции левого желудочка нарушается работа сердца и лёгких, снижается фракция выброса левого желудочка, учащается сердцебиение, прогрессирует гипотензия. Стадия длится несколько месяцев и завершается смертью больного, вызванной развитием дыхательной недостаточности и остановкой сердечной деятельности.
Различают стадии обострения и ремиссии:
- лёгкое обострение — не чаще раза в год, в период ремиссии клинических проявлений нет, работоспособность пациентов не изменена;
- обострение средней тяжести — 2-3 раза в год, сохраняется кашель, периодически поднимается температура, страдает работоспособность;
- тяжёлые обострения – следуют одно за другим, ремиссии почти нет, масса тела больного снижается, больные становятся инвалидами.
Критерии обострения:
- увеличивается частота дыхания;
- повышается температура тела;
- вес снижается более чем на 1 кг;
- усиливается кашель;
- увеличивается количество мокроты;
- появляются хрипы;
- снижается ОФВ1 (объём форсированного выдоха за первую секунду манёвра) на 10 % и более в сравнении с измеренным за последние три месяца;
- снижается уровень сатурации кислорода на 10 % и более по сравнению с измерением за три последних месяца;
- ухудшается переносимость физических нагрузок.
Осложнения муковисцидоза
Для муковисцидоза характерны следующие бронхолёгочные осложнения:
- ателектаз — спадание части лёгкого;
- абсцессы в лёгких — развитие в них полости с гнойным содержимым.
Пациенты жалуются на выраженную одышку, отмечаются симптомы сильной интоксикации, повышается температура и выделяется большое количество зловонной гнойной мокроты.
Одним из тяжёлых осложнений является спонтанный пневмоторакс — скопление воздуха в плевральной полости. Нарушение проявляется резкой колющей болью в грудной клетке, усиливающейся при дыхании, кашле и движениях. Больной начинает дышать часто и поверхностно, отмечается сильная одышка и чувство нехватки воздуха, беспокоит кашель, появляется синюшность кожных покровов лица.
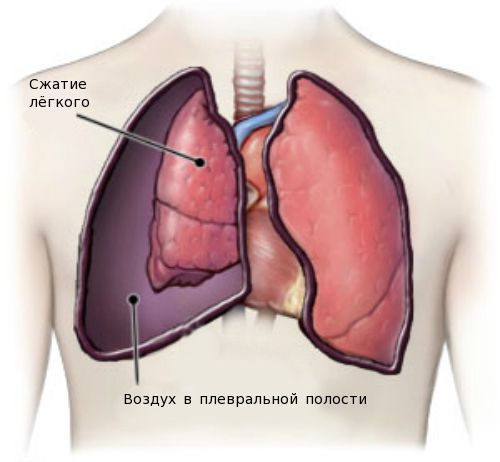
У больных старше 12 лет высока вероятность развития сахарного диабета I типа, может наблюдаться остеопороз, артриты и отёки нижних конечностей.
Постоянные или частые боли в животе могут указывать на панкреатит, эзофагит или язвенную болезнь желудка и двенадцатиперстной кишки.
Осложнять течение болезни может развитие фиброза печени различной степени выраженности, который чаще всего прогрессирует и в дальнейшем приводит к билиарному циррозу печени и портальной гипертензии. Муковисцидоз влияет на транспортировку ионов хлора, участвующих в перемещении желчи. При заболевании желчь по протокам не попадает в печень и её каналы, что ведёт к негативным последствиям — желчные протоки обезвоживаются, ткань печени замещаются соединительной тканью, происходит застой желчи (холестаз), развивается фиброз печени (цирроз) [11] .
У больных муковисцидозом часто наблюдаются такие осложнения, как выпадение прямой кишки и кишечная непроходимость, связанные с вязкостью кала. Кишечная непроходимость вызвана дегидратацией кишечного содержимого, нарушением моторики кишечника и внешнесекреторной недостаточностью функции поджелудочной железы. При патологии пациенты жалуются на боль в животе, вздутие, запор, рвоту и задержку газов. Если больному вовремя не оказана специализированная медицинская помощь, то он может погибнуть от развившегося некроза и перитонита [12] .
Диагностика муковисцидоза
Основной критерий постановки диагноза — увеличение концентрации ионов хлора в потовых железах более 60 ммоль/л вместе с одним или более из следующих критериев:
- хроническое заболевание дыхательных путей;
- экзокринная недостаточность поджелудочной железы;
- муковисцидоз близких – не далее двоюродных-родственников.
Эти критерии позволяют установить диагноз в 95 % случаев при недоступности генетического исследования мутации гена CFTR .
Характерные клинические проявления болезни:
- желудочно-кишечные нарушения;
- патологии бронхолёгочной системы и придаточных пазух носа;
- синдром потери солей;
- обструктивная азооспермия — сперматозоиды вырабатываются в нормальном количестве, но из-за нарушенной проходимости протоков не могут выйти наружу.
Скрининг на муковисцидоз проводится в роддоме всем новорождённым и направлен на выявление заболевания ещё до клинических проявлений. Для этого у ребёнка на 4-7 день жизни берётся кровь из пятки на фильтровальную бумагу и определяют уровень иммунореактивного трипсина (ИРТ). Если показатели ИРТ превышены (норма не более 65-70 нг/мл), то на 21-28 день анализ повторяют. Если показатели остаются повышенными, ребёнку проводится потовая проба и генетическое обследование.
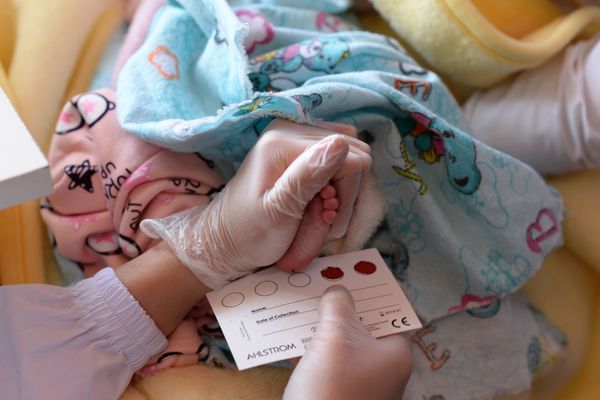
Потовая проба — это один из методов диагностики муковисцидоза, с помощью которого определяется уровень хлоридов в секрете потовых желез. Анализ проводится троекратно. Положительным результатом для постановки диагноза считается показатель выше 60 ммоль/л.
Методика проведения потовой пробы: кожу правого бедра новорождённого протирают раствором натрия хлорида, дают высохнуть, после кладут салфетку, смоченную раствором пилокарпина для провоцирования гипергидроза и вторую салфетку, смоченную солёной водой. На салфетках закрепляются электроды, в течение 5 минут подаётся разряд 4 мА, после чего электроды снимаются, и кожа протирается. На простимулированном участке фиксируется кусочек фильтровальной бумаги. Выделяющийся пот собирается в течение 30 минут, после чего бумагу снимают и отсылают в лабораторию для определения концентрации электролитов хлора и натрия.
Обзорную рентгенограмму брюшной полости проводят для выявления вздутых петель кишечника и признаков кишечной непроходимости. При осмотре может быть обнаружено увеличение печени (гепатомегалия). Также у пациентов выявляют сахарный диабет I типа, который сочетается с респираторными симптомами: одышкой, частым кашлем с трудноотделяемой вязкой мокротой и панкреатитом, проявляющимся опоясывающими болями в области живота и частым стулом непереваренной пищей.
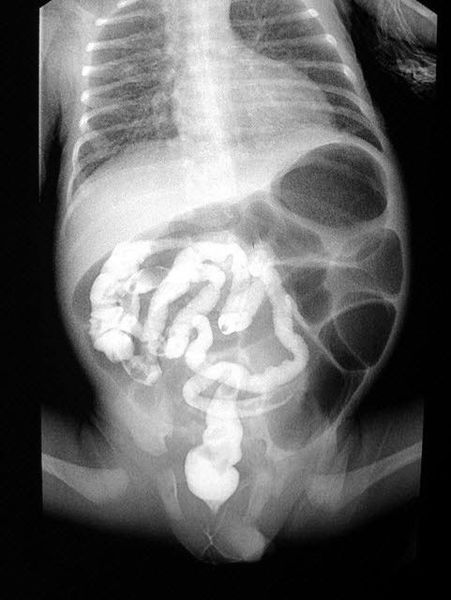
Обследование в несколько этапов необходимо, чтобы исключить ложноположительные результаты и подтвердить или опровергнуть диагноз [6] .
Молекулярно-генетический анализ позволяет диагностировать муковисцидоз приблизительно в 90 % случаев. Для его проведения нужна кровь из вены. Генетический метод обнаруживает в хромосомах пациента «дефектный» ген с мутацией F508del. При тестировании на муковисцидоз невозможно проверить все мутации, так как их более 1900, а большинство лабораторий выявляет только 20-30 самых частых вариантов.
Если в хромосомах не обнаруживается ни одной из 10-20 наиболее распространённых мутаций, то диагноз «муковисцидоз» маловероятен. В России генетические анализы недостаточно распространены, и не во всех регионах есть возможность такого тестирования [8] .
Лечение муковисцидоза
Муковисцидоз носит наследственный характер, поэтому его лечение большей частью симптоматическое, оно направлено на восстановление функций дыхательного и желудочно-кишечного тракта и проводится на протяжении всей жизни пациента. Больным муковисцидозом важно соблюдать диету, выполнять специальный комплекс упражнений и принимать препараты, предотвращающие развитие инфекций.
Основной целью лечения при муковисцидозе является удаление из дыхательных путей вязкой мокроты. Для этого применяют различные методики дренирования бронхиального дерева, например кинезотерапию — одну из форм лечебной физкультуры, способствующую очищению бронхов от вязкой и агрессивной слизи.
- Углублённые вдох и выдох, позволяющие слизи легче отделяться от стенок бронхов.
- Дыхание с сопротивлением губами.
- Мобилизация — упражнения для повышения эластичности грудной клетки, позвоночника и мышечного баланса тела.
Физиотерапевтическое лечение младенцев и детей раннего возраста включает как активную, так и пассивную техники.
Пассивная техника:
• принятие телом ребёнка определённого положения на короткое время, затем его изменение;
• сопровождение и стимуляция дыхательных движений при помощи рук (контакт-дыхание) — техника, при которой рука физиотерапевта ведёт и стимулирует дыхательные движения;
• ручная вибрация на выдохе — для поддержки выдоха и помощи высвобождению мокроты потряхивается грудную клетку рукой;
• потряхивание — ритмические движения, выполняемые в одной из частей тела для возникновения реакции в грудной клетке;
• терапевтические положения тела — расположение грудной клетки в состоянии, при котором растягивается лёгочная ткань и расширяются дыхательные пути.
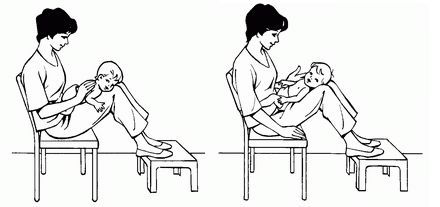
Активная техника:
• влияние на дыхание, например с помощью акустической стимуляции — поощряя ребёнка повторять громкие крики, которые он издаёт;
• упражнения для развития эластичности грудной клетки, позвоночника и мышечного баланса тела;
• упражнения, повышающие ловкость, выносливость и формирующие наслаждение от мышечной активности.
Важную роль при лечении играют аппаратные методы. Широкое распространение получил аппарат «виброжилет», состоящий из надувного жилета и блока генератора пневмоимпульсов, который создаёт давление на грудную клетку. Такие колебания воспроизводят эффект кашля и помогают очистить бронхи от вязкой мокроты. Аппаратные методы применяют вместе с медикаментозной терапией [13] .
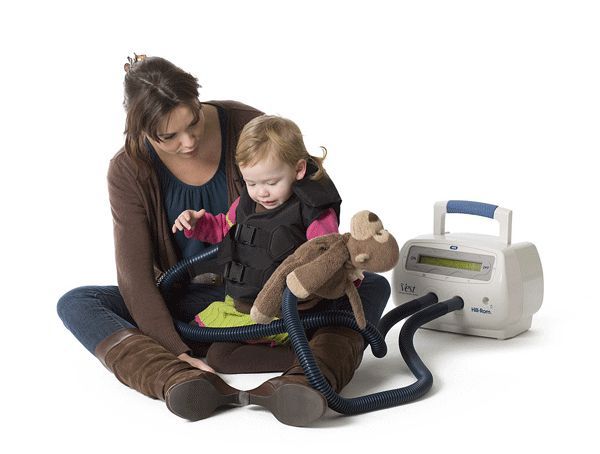
При муковисцидозе важно соблюдать диету — питание должно быть высококалорийным, с повышенным содержанием белков и жиров. Пищу принимают часто и небольшими порциями, дополнительно подсаливая. Из рациона исключается еда, которая тяжела для переваривания: грубая клетчатка, навары из супов, жареные блюда, шоколад, торты, пирожные. Суточный калораж должен превышать возрастную норму на 20—40 %, главным образом за счёт увеличенного количества белка (до 6 г на 1 кг массы тела в сутки). Из-за нарушенной функции поджелудочной железы у больных не усваиваются жиры и жирорастворимые витамины А, Д, Е и К, поэтому необходим их дополнительный приём.
Для облегчения отхождения мокроты применяют следующие препараты:
-
в таблетках по 30 мг. В период ремиссии лекарство принимают один раз в сутки, во время обострения заболевания — до шести раз.
- Дорназа альфа — генно-инженерный вариант природного фермента человека, который помогает расщеплять гнойную мокроту. Применяется с помощью небулайзера по 2,5 мг один раз в сутки.

Для ингаляционной терапии используют бронхолитики:
-
— на одну процедуру в небулайзере нужно 20 капель беродуала + 3,0 мл физраствора. Ингаляции делают два раза в день утром и вечером в течение 7-10 дней. — препарат заливают в небулайзер в неразбавленном виде, стандартная доза 2,5 мл, в сутки разрешается делать не больше четырёх ингаляций. — на одну процедуру нужно 1 мл препарата + 1 мл. физраствора, дважды в день утром и вечером в течение пяти дней.
Следует иметь в виду, что у трети больных бронхолитики оказывают положительный ответ, но у большей части может возникнуть коллапс мышц дыхательных путей и резкое снижение объёма выдыхаемого воздуха. В связи с этим больные, получающие такую терапию, должны находиться под наблюдением врача.
Антибактериальные препараты назначаются всем пациентам с лёгочными симптомами, при обострениях заболевания или выявлении возбудителей респираторных инфекций для подавления их роста.
Для лечения применяют эффективные комбинации антисинегнойных антибиотиков:
Парентеральные антибиотики:
- цефалоспорины + аминогликозиды;
- антисинегнойные пенициллины + аминогликозиды;
- карбапенемы + аминогликозиды;
- фторхинолоны + аминогликозиды;
- цефалоспорины + фторхинолоны;
- антисинегнойные пенициллины + фторхинолоны;
- карбапенемы + фторхинолоны;
- цефалоспорины + карбапенемы + аминогликозиды [10] .
Доза вводимого антибактериального препарата должна превышать среднюю терапевтическую в полтора раза. Курс антибактериальной терапии может продолжаться до 3-4 недель,в случае хронизации инфекционного процесса — до 12 недель.
Для улучшения функции пищеварения используют ферментные препараты, которые содержат липазу, протеазу и амилазу, облегчающие переваривание жиров, углеводов и белков, а также способствующие их лучшему всасыванию в тонком кишечнике. Подбор доз панкреатических ферментов проводится индивидуально исходя из клинических проявлений болезни. Применяются препараты: «Панкреатин», «Мезим», «Креон». Ферментные препараты назначаются в больших дозах, чем больным с другими заболеваниями желудочно-кишечного тракта — до 30 капсул «Креона» в сутки.
Лечение муковисцидоза пожизненное. Выбор схемы терапии зависит от вида бактерий, обнаруженных в бронхиальном секрете дыхательных путей, а также от преобладающих клинических форм заболевания.
«В последние годы для лечения муковисцидоза начали применять таргетную генетическую терапию, которая направлена на исправление дефекта в самой распространённой мутации F508del [14] . Препарат продаётся в США под маркой «Trikafta». В августе 2020 года лекарство было одобрено Европейской комиссией для применения в ЕС под наименованием «Kaftrio»». — прим. ред. «ПроБолезни».
В России оригинальные препараты для лечения муковисцидоза заменяются дженерикам отечественного производства. Дженерики сходны с оригинальными препаратами по составу действующего вещества. Многие пациенты жалуются на их плохое качество и появление побочных эффектов. В последнее время пациентами и родителями больных муковисцидозом проводятся кампании, цель которых — вернуть государственное обеспечение качественными иностранными лекарствами.
Назвать побочные эффекты дженериков на данный момент сложно, так как отсутствуют их сравнительные исследования с оригинальными препаратами.
В рамках 44-ого ФЗ закупки лекарственных препаратов идут по международному непатентованному названию. Перечень лекарственных препаратов утверждается правительством РФ. Врачам за назначение препаратов под торговыми названиями или купленными родителями и благотворительными фондами грозит ответственность. В рецептах, выписанных врачом, должны быть указаны только международные названия, а не торговые. За нарушение этого правила врачей ждет штраф.
Хотя есть одно условие: при наличии медицинских показаний (аллергия, индивидуальная непереносимость дженерика по жизненным показаниям) по решению врачебной комиссии пациент может получить лекарство под торговым названием. Поэтому возможность получить оригинальный препарат — индивидуальная непереносимость дженерика (которую нужно доказать) и решение врачебной комиссии.
Муковисцидоз — наиболее частое показание для трансплантации лёгких. Основные показания для этой операции: прогрессирующее снижение веса, ухудшение лёгочной функции, частые обострения, потребность в кислородотерапии. Противопоказания: аспергиллома ( опухолевоподобное неинвазивное новообразование шаровидной формы, состоящее в основном из клеток мицелия микроскопического плесневого гриба ), курение, психосоциальные факторы. Сахарный диабет и лечение кортикостероидами не являются препятствием для трансплантации.
Прогноз. Профилактика
Муковисцидоз — это неизлечимое хроническое заболевание, но при своевременной диагностике и адекватной постоянной терапии многие пациенты доживают до взрослого возраста.
Для больных муковисцидозом возможна полноценная жизнь, но только при условии постоянного получения необходимых препаратов. Основными причинами смертности этих пациентов являются бронхолёгочные осложнения: развитие инфекции в нижних дыхательных путях, бронхоэктазы и хроническая обструктивная болезнь легких (ХОБЛ).
Доля пациентов старше 18 лет за последнее 10 лет увеличилась, выживаемость составила 31,8 % [3] . Увеличение продолжительности жизни обусловлено ранним выявлением заболевания, оптимизацией работы центров муковисцидоза и применением эффективных медикаментозных препаратов, в частности дорназы альфа («Пульмозим»), некоторых ингаляционных и системных антибиотиков и макролидов [9] . Дорназа альфа способствует снижению вязкости мокроты и обладает отхаркивающим действием. Использование небулайзера помогает быстро доставить ингаляционные антибиотики в поражённую область.
Главным способом профилактики является дородовая и неонатальная диагностика. Семейным парам, планирующим рождение ребенка, рекомендуется пройти ДНК-диагностику на носительство мутаций, приводящих к муковисцидозу, с последующей консультацией врача-генетика.
Пренатальная ДНК-диагностика выполняется при заборе околоплодных вод в ранний (13-14 недель) и поздний (16-20 недель беременности) сроки. Обследование проводят для семей, в которых выявлено носительство мутации гена CFTR и имеющих ребёнка больного муковисцидозом.
Гастроинтестинальные проявления пищевой аллергии у детей
Рассмотрены атопические и эозинофильные заболевания пищеварительного тракта — гастроинтестинальная гиперчувствительность, оральный аллергический синдром, проктоколит и энтеропатия, индуцированные пищевыми белками, эозинофильный эзофагит и др.
The author analyses atopic and eosinophilic digestive system diseases – gastrointestinal hypersensitivity, oral allergic syndrome
Среди всех неблагоприятных реакций на пищу пищевая аллергия является одной из самых обсуждаемых проблем как среди педиатров, так и среди врачей-специалистов (аллергологов, нутрициологов, гастроэнтерологов). К сожалению, на сегодняшний день отсутствуют точные данные о распространенности пищевой аллергической реакции в мире. Это связано, с одной стороны, с многочисленными проявлениями заболевания, затрагивающими многие органы и системы, а с другой стороны — с трудностями точной верификации диагноза в клинической практике. Предположительно в мире насчитывается примерно 220–520 млн человек, страдающих пищевой аллергией [29].
Далеко не все неблагоприятные реакции на пищу относятся к пищевой аллергии. Исходя из общепринятого определения, к пищевой аллергии относят только иммунологически обусловленные реакции. К неблагоприятным реакциям на пищу относятся и целый ряд метаболических заболеваний, токсических реакций, непереносимость пищевых продуктов и т. д. (рис. 1).
![Рис. 1. Неблагоприятные реакции на пищу [30]](https://www.lvrach.ru/FileStorage/ARTICLE/Lechacshij_vrach/2012-02/01_12/13118836/Lechacshij_vrach_017-1_(7063).jpg)
Рис. 1. Неблагоприятные реакции на пищу [30]
К сожалению, существует как гипер-, так и гиподиагностика пищевой аллергии. По мнению большинства исследователей, именно 8 аллергенов вызывают подавляющее число аллергических реакций (рис. 2). По последним данным аллергия на коровье молоко (АБКМ) стабильно занимает второе место (после куриного яйца) как в Европе, так и в США и Японии. Жалобы родителей на аллергию к коровьему молоку колеблются в диапазоне от 1% до 17,5% у детей до 5 лет, от 1% до 13,5% у детей 5–16 лет и от 1% до 4% у взрослых [28, 29]. Пищевая аллергия чаще встречается у детей, чем у взрослых, и представляет собой серьезную глобальную проблему.
.jpg)
Рис. 2. Основные пищевые аллергены
Основные аллергены коровьего молока сосредоточены в сывороточной и казеиновой фракциях. К сывороточным аллергенам коровьего молока относятся: альфа-лактоальбумин (Bos d4), бета-лактоглобулин (Bos d5), бычий сывороточный альбумин (Bos d6), бычьи иммуноглобулины (Bos d7). Казеиновые аллергены (группа, известная как Bos d8) состоят из четырех разных белков (альфа1-, альфа2-, бета- и каппа-казеин). Чаще всего пациенты чувствительны к альфа- (100%) и каппа-казеинам (91,7%). Для практической работы важно помнить, что козье молоко очень близко по антигенному составу к коровьему молоку, поэтому перевод ребенка на козье молоко при наличии у него АБКМ неоправдан. Кроме того, аллергенами молока млекопитающих являются белки, поэтому назначение безлактозного молока детям, страдающим аллергией на коровье молоко, выглядит абсолютно абсурдным. Аллергены молока остаются биологически активны даже после кипячения, пастеризации, ультравысокотемпературной обработки и выпаривания. Получение гипоаллергенной смеси — это высокотехнологическая процедура, включающая в себя гидролиз с последующей термообработкой, ультрафильтрацией и применением высокого давления. В последнее время появились так называемые аминокислотные смеси, которые вообще не содержат белка, а в состав их входит необходимый набор аминокислот. Клинические проявления аллергии к белкам коровьего молока отличаются разнообразием и часто маскируются под хорошо известные проявления других заболеваний. Наиболее часто у детей с АБКМ обнаруживают кожные проявления (от 5% до 90%). Около 1/3 детей с атопическим дерматитом имеют молочную аллергию [30]. Острые реакции в виде анафилаксии встречаются значительно реже, но прогностически — это наиболее опасные проявления АБКМ. Поражения респираторного тракта проявляются и в виде аллергического ринита и в виде бронхиальной астмы при участии IgE-зависимых механизмов. Особой формой молочной аллергии является синдром Хейнера, или болезнь молочных преципитинов, обусловленная не-IgE-механизмами. Аллергическое поражение желудочно-кишечного тракта имеют по данным разных исследователей от 32% до 60% больных с молочной аллергией [30]. К сожалению, клинические проявления гастроинтестинального поражения у больных с АБКМ не всегда манифестны, что существенно затрудняют диагностику и, как следствие этого, адекватное лечение.
Существует целый спектр аллергических заболеваний пищеварительного тракта (табл. 1). Непосредственно к атопическим, т. е. IgE-опосредованным, относятся лишь немедленная гастроинтестинальная гиперчувствительность и оральный аллергический синдром. В основе белок-индуцированных энтеропатии и колита лежат клеточные реакции. Группировка этих заболеваний, исходя из ведущего иммунологического механизма, имеет практическое значение. Например, рrick-тесты (кожный тест-укол) и RAST (определение антител класса E) обладают высокой информативностью у пациентов с IgE-опосредованными заболеваниями и практически бесполезны при обследовании детей с заболеваниями, при которых ведущую роль играют клеточные механизмы. В отдельную группу выделяют эозинофильные заболевания пищеварительного тракта. В их патогенезе участвуют как IgE-зависимые, так и клеточные механизмы, где ключевое значение имеют эозинофилы. Морфологическими особенностями, характерными для этой группы заболеваний, являются преобладание в воспалительном инфильтрате эозинофилов, их группировка (эозинофильные микроабсцессы), внедрение в эпителий и дегрануляция.
Эозинофилы функционируют как антиген-презентирующие клетки, а также индуцируют воспалительный процесс при участии специальных белков — EDGP (Eosinophil-Derived Granule Proteins). В их состав входят катионные белки эозинофилов (ECP), эозинофильный нейротоксин (EDN), пероксидаза эозинофилов (EPO) и так называемый major basic protein (MBP). Эти белки обладают цитотоксическим эффектом на эпителий пищеварительного тракта, а также вызывают дегрануляцию тучных клеток с высвобождением цитокинов (IL-1, IL-3, IL-4, IL-5, IL-13, трансформирующий фактор роста), хемокинов (эотоксин) и нейромедиаторов (субстанция P, вазоактивный интестинальный полипептид) [1, 2].
Немедленная гастроинтестинальная гиперчувствительность
Немедленная гастроинтестинальная гиперчувствительность (НГГ) — это IgЕ-опосредованное заболевание, характеризующиеся появлением тошноты, рвоты и боли в животе спустя несколько минут/1–2 часа после употребления «причинных» продуктов. Диарея может присоединяться через 2–6 часов [3].
Часто симптомы со стороны желудочно-кишечного тракта сочетаются с реакциями гиперчувствительности I типа со стороны кожи, глаз, дыхательной системы, а также анафилактической реакцией. Однако гастроинтестинальные симптомы могут быть единственным проявлением пищевой аллергии даже у тех пациентов, у которых те же аллергены вызывают IgE-опосредованные реакции со стороны других органов и систем. Например, у ребенка с атопическим дерматитом, обусловленным сенсибилизацией к пищевому аллергену (и наличием специфических IgE) употребление «причинного» продукта может вызвать только проявления НГГ без каких-либо симптомов со стороны кожи [4].
Чаще всего НГГ вызывают молоко, яйца, арахис, соя, пшеница и морепродукты. Как и при других IgE-опосредованных заболеваниях, аллергия к молоку, яйцам, пшенице и сое с возрастом, как правило, проходит. Непереносимость арахиса, лесных орехов и морепродуктов может сохраняться в течение всей жизни.
В диагностике наряду с анамнестическими данными выявляют повышенный уровень специфических IgE и положительные кожные prick-тесты.
Оральный аллергический синдром
Оральный аллергический синдром (ОАС) — это IgЕ-опосредованное заболевание, характеризующееся появлением покраснения, зуда, жжения в ротовой полости, а также отеком губ, языка и неба [3]. Симптомы развиваются сразу после употребления некоторых свежих фруктов и овощей. Нередко дети отказываются есть «причинные» продукты. В 1–2% случаев могут развиваться тяжелые аллергические реакции [5]. ОАС дебютирует, как правило, после года (в дошкольном возрасте) и ассоциируется с сезонным аллергическим ринитом и/или конъюнктивитом. Дебюту этого синдрома почти всегда предшествует сенсибилизация пыльцой, содержащей белки, гомологичные тем, что находятся в определенных фруктах и овощах. При этом пациент, сенсибилизированный к пыльце, может реагировать на пищевой аллерген без предшествовавшего с ним контакта. Например, сенсибилизация к пыльце амброзии полыннолистной может сочетаться с ОАС после употребления дыни, а сенсибилизация к пыльце березы может приводить к появлению этого синдрома после употребления яблок, персиков и вишни. Кроме того, могут быть перекрестные реакции между латексом и бананом, авокадо, персиком, киви, абрикосом, грейпфрутом, маракуйей, ананасом, каштаном. Белки, индуцирующие ОАС, термолабильны, поэтому употребление фруктов и овощей, прошедших кулинарную обработку, не приводит к появлению симптомов. Диагностика ОАС базируется на типичном анамнезе и на основании результатов prick-тестов и IgE в сыворотке крови.
Проктоколит, индуцированный пищевыми белками
Проктоколит, индуцированный пищевыми белками (ПИПБ), — не-IgE-опосредованное заболевание, вызванное иммунным ответом против пищевых белков, характеризующееся наличием слизи и/или крови в стуле у внешне здорового младенца. Обычно заболевание дебютирует в течение первых 6 месяцев (в среднем в 2 месяца), хотя манифестировать болезнь может с первых дней жизни [6].
В 60% случаев ПИПБ встречается у детей, находящихся на естественном вскармливании. В этом случае иммунный ответ направлен на продукты, входящие в рацион матери. Чаще всего аллергическая реакция развивается на белки коровьего молока и сои. Несколько реже на яйца, орехи, арахис и морепродукты. У детей, находящихся на искусственном вскармливании, реакция, как правило, развивается на белки коровьего молока и сои, входящие в состав смесей [7].
ПИПБ является наиболее частой причиной ректального кровотечения у грудных детей. Появление крови в стуле связано с повышенной ранимостью воспаленной слизистой толстой кишки, а в ряде случаев с наличием эрозий [8]. Кровь может быть смешана со слизью или быть в виде вкраплений и прожилок (что часто ошибочно расценивают как проявление перианальных трещин). Кровопотеря, как правило, минимальна и не ведет к развитию гематологических изменений.
Слизь в кале (в виде прожилок или тяжей) может быть единственным проявлением ПИПБ (кровь макроскопически может не определяться). При микроскопии в слизи обнаруживают повышенное количество лейкоцитов, значительная часть которых представлена эозинофилами.
Иногда основные симптомы ПИПБ ассоциируются с кишечной коликой и увеличением частоты опорожнения кишечника. Важно помнить, что несмотря на наличие таких серьезных симптомов, как слизь и кровь в стуле, дети практически всегда выглядят здоровыми и хорошо прибавляют в весе. Это следует учитывать в дифференциальной диагностике ПИПБ с другими заболеваниями (например, кишечными инфекциями, воспалительными заболеваниями кишечника), при которых, как правило, наряду с симптомами гемоколита имеют место тяжелое состояние ребенка, обезвоживание, плохие весовые прибавки или похудание, а также выраженные гематологические изменения.
Необходимо иметь в виду, что у детей с ПИПБ маркеры атопии (атопический дерматит, отягощенный аллергический семейный анамнез, повышение уровня эозинофилов в крови) встречаются не намного чаще, чем в обычной популяции [7]. Редко можно обнаружить повышение титра общего и специфических IgE, а также положительные кожные prick-тесты. Это объясняется не-IgE-зависимым механизмом развития данного заболевания [3].
_550.jpg)
Рис. 3. Эндоскопические изменения при ПИПБ
Для диагностических целей эндоскопическое исследование обычно не требуется, но в тех случаях, когда его проводят, обнаруживают эритему, контактную ранимость, ослабление сосудистого рисунка и лимфонодулярную гиперплазию. В тяжелых случаях обнаружают эрозии. Изменения, как правило, локализуются в прямой кишке, но иногда захватывают всю толстую кишку [9] (рис. 3). При гистологическом исследовании обнаруживают увеличенное число эозинофилов в собственной пластинке слизистой оболочки (> 6 эозинофилов ×400). В тяжелых случаях наблюдают внедрение эозинофилов в эпителий крипт (эозинофильный криптит), скопления эозинофилов (эозинофильные микроабсцессы) и наличие нейтрофилов (активное воспаление) [10] (рис. 4). Несмотря на сообщения о периферической эозинофилии и выявлении IgE-специфических антител, они обнаруживаются редко [3].
Лечение ПИПБ заключается в элиминации аллергена из рациона кормящей матери (если ребенок находится на естественном вскармливании) или переводе на смеси с глубоким гидролизом белков (если ребенок получает смесь на основе коровьего молока или сои). Однако в 10% случаев развитие ПИПБ возможно у детей, получающих смеси на основе глубокогидролизованных белков коровьего молока. В этой ситуации ребенка переводят на аминокислотные смеси, что ведет к полному исчезновению симптомов [6].
Рис. 4. Гистологические изменения при ПИПБ
Энтеропатия, индуцированная пищевыми белками
Энтеропатия, индуцированная пищевыми белками (ЭИПБ), характеризуется хронической диареей, рвотой, мальабсорбцией и плохой прибавкой в весе. Дополнительными признаками могут быть: вздутие живота, чувство быстрого насыщения и перианальный дерматит. В тяжелых случаях может развиться белоктеряющая энтеропатия, которая сопровождается гипопротеинемией и отеками.
Чаще всего заболевание развивается у детей первых месяцев жизни, находящихся на искусственном вскармливании, в результате иммунной реакции на белки коровьего молока или сои. Реже ЭИПБ может быть вызвана злаками, овсом, яйцами, рисом, рыбой и морепродуктами. В этих случаях заболевание дебютирует в зависимости от сроков введения «причинных» продуктов [6].
ЭИПБ может дебютировать после острого вирусного гастроэнтерита. Это может быть связано как с реализацией «замаскированной» гиперчувствительности, так и с патологической иммунной реакцией слизистой кишечника в ответ на поступление антигенов в период повышенной проницаемости кишечного барьера [11].
Нередко ЭИПБ развивается у детей, находящихся на естественном вскармливании. При этом симптомы могут появиться даже в течение первых 2 недель жизни [12]. У таких пациентов может быть реакция одновременно на многие продукты, входящие в рацион кормящей матери. В этой группе низкие прибавки в массе отмечаются примерно в 25% случаев, причем нередко с рождения [13].
Несмотря на то, что ЭИПБ относится к не-IgE-опосредованным заболеваниям, у этих пациентов могут быть сопутствующие состояния, обусловленные немедленными аллергическими реакциями. В частности, отягощенная наследственность, высокий уровень общего IgE, положительные prick-тесты, а также экзема, крапивница, ангионевротический отек и анафилактические реакции в анамнезе. Сочетание симптомов поражения пищеварительного тракта с симптомами гиперчувствительности немедленного типа позволяют врачу подумать об этом заболевании.
Гораздо сложнее заподозрить ЭИПБ в тех случаях, когда симптомы со стороны пищеварительного тракта не ассоциируют с отягощенной наследственностью и очевидными аллергическими реакциями на пищу. Общий IgE может быть нормальным, а специфические IgE и кожные тесты отрицательными. Редко думают об ЭИПБ при отсутствии одного из основных симптомов этого заболевания — низкой прибавке в массе тела. В этом случае на первый план выходят симптомы нарушения моторики: гастроэзофагеальный рефлюкс, кишечная колика, раздражительность [14].
Для диагностики необходимо сделать эндоскопию и гистологическое исследование. Наиболее характерным эндоскопическим признаком ЭИПБ является лимфонодулярная гиперплазия (симптом «булыжной мостовой») (рис. 5). При гистологическом исследовании обнаруживают атрофию, мононуклеарную инфильтрацию собственной пластинки слизистой тонкой кишки в сочетании с увеличением числа интраэпителиальных лимфоцитов [6]. Эти изменения очень напоминают целиакию. Но при ЭИПБ не повышается титр антител к тканевой трансглютаминазе и эндомизию и реже обнаруживают HLA-маркеры глютеновой энтеропатии (DQ2 и DQ8) [15]. В отличие от целиакии, ЭИПБ, как правило, проходит через 1–2 года и повышает риск малигнизации.
.jpg)
Рис. 5. Энтеропатия, индуцированная пищевыми белками
Окончательный диагноз устанавливают с помощью элиминационной диеты и провокационного теста.
АБКМ — одна из наиболее распространенных причин энтероколитического синдрома (FPIES), формы не-IgE-опосредованной аллергии, которая развивается в течение 1–3 часов после введения молочного белка. FPIES проявляется следующими симптомами: повторяющейся рвотой, гипотонией, бледностью, иногда — гипотензией и диареей. FPIES часто проявляется с первым введением коровьего молока в рацион, но не зафиксирован у детей на грудном вскармливании. Ремиссия обычно развивается в течение первых нескольких лет жизни. Вызванный коровьим молоком энтеропатический синдром — редкая болезнь, обычно проявляется диареей, потерей в весе, различными степенями рвоты, периодической гипопротеинемией и стулом с кровью. Хотя многие дети с этой болезнью положительно отвечают на высокогидролизные смеси, основанные на коровьем молоке, некоторым для достижения ремиссии заболевания необходим перевод на аминокислотные смеси.
Эозинофильный эзофагит
Эозинофильный эзофагит (ЭЭ) — заболевание, характеризующееся изолированной выраженной эозинофильной инфильтрацией пищевода и манифестирующее рефлюкс-подобными симптомами (отрыжка, боль в эпигастрии или за грудиной, рвота, изжога, трудности кормления и дисфагия), не отвечающими на антисекреторную терапию. ЭЭ встречается в любом возрасте и может осложняться стриктурами пищевода, образованием колец Schatzki и ахалазией. Эти осложнения связаны с тем, что эозинофильное воспаление может приводить к развитию фиброза и ремоделированию пищевода [16].
Распространенность ЭЭ точно не определена и колеблется в пределах от 1 до 9 на 100 000 населения. По данным детского госпиталя в Питсбурге (США), обслуживающего примерно 1 миллион детей, ежегодно диагностируется около 100 новых случаев ЭЭ. Мальчики болеют чаще девочек. Заболевание чаще встречается среди школьников и молодых взрослых [17].
Примерно у 50% детей отмечаются проявления аллергии со стороны других органов и систем: бронхоспазм, аллергический ринит, экзема. У 35% больных с этим заболеванием отягощен аллергологический анамнез, а у 50–80% имеются атопические заболевания [18].
У детей младшего возраста в клинической картине ЭЭ доминируют рефлюкс-подобные симптомы и трудности при кормлении (отказ от еды, избегание пищи определенной консистенции).
У подростков и взрослых ЭЭ чаще всего проявляется симптомами дисфагии и/или эпизодами застревания пищи в пищеводе. Эти явления могут быть вызваны как преходящим спазмом гладкой мускулатуры пищевода, так и ремоделированием пищевода (стриктуры, кольца), обусловленным хроническим эозинофильным воспалением [19].
Ключевую роль в диагностике играют эндоскопия и гистология. Однако в план обследования необходимо включить и рентгенологическое исследование с барием, позволяющее исключить аномалии развития пищевода, стриктуры и кольца Schatzki (которые могут быть пропущены при эндоскопическом исследовании).
_550.jpg)
Рис. 6. Эозинофильный эзофагит: эндоскопическая картина
ЭЭ может быть заподозрен при обнаружении следующих эндоскопических признаков (рис. 6):
- Воспалительные изменения одинаково выражены как в дистальной, так и в средней части пищевода (в отличие от рефлюкс-эзофагита, при котором наибольшие изменения находят в дистальном отделе).
- Линейные вертикальные борозды.
- Циркулярные складки («кольца»).
- Налет на слизистой в виде белых «крупинок» (≈1 мм в диаметре).
- Контактная кровоточивость [19].
Биоптаты следует брать как из дистальной, так и из средней трети пищевода (где при ЭЭ обнаруживают наибольшее число эозинофилов). В связи с тем, что патологические изменения могут иметь «пятнистый» характер, необходимо брать не менее 5 биоптатов [20]. Диагноз «эозинофильный эзофагит» не может быть поставлен без проведения гистологического исследования. В норме слизистая оболочка пищевода у детей не содержит эозинофилов. При гастроэзофагеальном рефлюксе обнаруживают в среднем 1–5 интраэпителиальных эозинофила в поле зрения (при увеличении ×400) [20]. В случае тяжелого рефлюкс-эзофагита число интраэпителиальных эозинофилов может достигать 10–15 в поле зрения (×400) (рис. 7).
_550.jpg)
Рис. 7. Эозинофильный эзофагит: гистология
При ЭЭ обнаруживают более 15 интраэпителиальных эозинофилов, а в тяжелых случаях их число может достигать 45 и даже 100 клеток в поле зрения (×400). Для ЭЭ характерно поверхностное расположение эозинофилов, образование их скоплений (микроабсцессы — белые «крупинки», определяемые при эндоскопии) и дегрануляция [20].
Следует иметь в виду, что эозинофильная инфильтрация слизистой оболочки пищевода может встречаться не только при рефлюксной болезни и эозинофильном эзофагите, а также при болезни Крона, целиакии и васкулитах.
Подумать об ЭЭ необходимо в тех случаях, когда у пациента с симптомами рефлюкса и/или дисфагией эмпирическая антисекреторная терапия неэффективна. Особенно если это наблюдается у пациента с аллергическим заболеванием.
Окончательно ЭЭ подтверждается повторной эндоскопией с биопсией после лечения.
Лечение ЭЭ включает элиминационную диету и фармакотерапию, направленную на подавление эозинофильного воспаления (табл. 2).
В нетяжелых случаях элиминационная диета может быть использована как монотерапия. Те или иные продукты могут быть исключены из рациона как на основании аллергообследования, так и эмпирически. Поскольку ЭЭ не является «чистым» IgE-зависимым заболеванием, то, к сожалению, полагаться на результаты аллергопроб на 100% нельзя. В последние годы используют эмпирическую элиминационную диету с исключением 6 продуктов: молока, сои, яиц, пшеницы, арахиса и морепродуктов. Эффективность этого подхода превышает 80% [21]. Альтернативой является использование смесей на основе аминокислот. Иногда, учитывая вкусовые пристрастия пациентов, в смеси добавляют фруктовые соки [19]. Клинически улучшение наступает, в среднем, через 8 дней, а нормализация гистологической картины через 4 недели [22].
В тяжелых случаях, наряду с элиминационной диетой, используют противовоспалительные препараты. Системные стероиды (преднизолон, метилпреднизолон) эффективно подавляют воспаление и купируют симптомы. Однако их применение ограничено в связи с побочными эффектами и 90% вероятностью рецидива после отмены. Местное лечение стероидами (флютиказон и будесонид) эффективно в 80% случаев и не сопряжено с системными побочными эффектами. Флютиказон вводят через рот с помощью дозированного ингалятора (без спейсера). Аэрозоль, не вдыхая, распыляют в ротовую полость. Лекарство попадает в пищевод со слюной, оказывая местный противовоспалительный эффект. Вязкую суспензию будесонида готовят, используя содержимое небул. Наиболее частым побочным эффектом местного лечения стероидами является кандидоз пищевода, который встречается у 10–15% пациентов.
Монтелукаст обладает неплохим симптоматическим эффектом, однако не уменьшает эозинофильную инфильтрацию в пищеводе, что, теоретически, сохраняет вероятность ремоделирования пищевода. В настоящее время идут II и III фазы клинических испытаний препаратов на основе моноклональных антител к IgE (омализумаб) и IL-5 (реслизумаб, меполизумаб). Несмотря на обнадеживающие предварительные результаты, омализумаб, при хорошем симптоматическом эффекте, не снижает эозинофильную инфильтрацию, а реслизумаб и меполизумаб хоть и снижают тканевую эозинофилию, не устраняют симптомы [23].
Эозинофильный гастрит, гастроэнтерит, гастроэнтероколит (ЭГ)
ЭГ входят в семейство эозинофильных заболеваний желудочно-кишечного тракта. В отличие от ЭЭ эозинофильная инфильтрация редко ограничивается одним органом (только желудком или только тонкой кишкой). Обычно эозинофильное воспаление захватывает сразу несколько отделов пищеварительной трубки. Чаще одновременно поражается желудок и тонкая кишка (эозинофильный гастроэнтерит). Клиническая картина зависит от того, какой слой пищеварительной трубки инфильтрирован эозинофилами. Если в патологический процесс вовлечена только слизистая оболочка, то доминируют боль в животе, тошнота, рвота и диарея. Если эозинофилы сосредоточены в мышечном слое, то на первый план выходят симптомы непроходимости (тошнота, рвота, вздутие живота). В том случае, если эозинофилы сконцентрированы в субсерозном слое, то заболевание проявляется асцитом, а в асцитической жидкости обнаруживают большое число эозинофилов [17].
Эндоскопическое исследование с биопсией информативны только при поражении слизистой оболочки. Макроскопически обнаруживают эритему, эрозии, нодулярность или полипоидные разрастания в антруме и/или тонкой кишке. При гистологическом исследовании в воспалительном инфильтрате доминируют эозинофилы, количество которых превышает 20 клеток в поле зрения (×400). В связи с тем, что патологические изменения носят фокальный характер, необходимо брать не менее 5 биоптатов из каждого отдела пищеварительной трубки, причем биопсию следует делать как из измененных, так и из внешне нормальных участков [24].
Если эозинофилы инфильтрируют мышечный или субсерозный слои, то диагноз может быть установлен при гистологическом исследовании биоптатов, полученных интраоперационно, а также при цитологическом анализе асцитической жидкости.
При ЭГ наиболее эффективно лечение системными стероидами (20–40 мг в сутки), которые дают четкий положительный эффект уже через 1–2 недели. В одних случаях удается быстро снизить дозу (в течение 2 недель) и прекратить прием препарата. В других случаях пациенты вынуждены получать длительно поддерживающие дозы (5–10 мг/сут).
Как и при ЭЭ, неплохую эффективность показала эмпирическая элиминационная диета. Сообщалось об удовлетворительных результатах применения Кетотифена и Кромолина [26, 27].
Диета детей с гастроинтестинальными проявлениями пищевой аллергии
Необходимым методом лечения детей с аллергическими реакциями следует считать полную элиминацию причинного аллергена. Именно частичная элиминация аллергена (сознательная или случайная) является самой частой причиной безуспешного лечения детей с пищевой аллергией. Конечно, установление причинно-значимого аллергена — это очень трудная задача, но абсолютно необходимая. Современный алгоритм диагностики спектра причинных аллергенов включает в себя анализ клинической картины заболевания, оценку дополнительных методов исследования (рrick-тесты и уровня специфических IgE), эффекта элиминации и проведения провокационных тестов. В случае не-IgE-зависимых иммунных реакций отсутствуют общепризнанные методы лабораторной диагностики причинных аллергенов. При доказанной причинности выявленного аллергена следует устранить его в диете пациента на срок, зависящий от очень многих факторов. Одной из часто встречающихся ошибок при появлении признаков пищевой аллергии является перевод ребенка с естественного вскармливания на искусственное с использованием смесей с высокой степенью гидролиза. Такую практику следует признать как недопустимую. В настоящее время отсутствуют убедительные данные в пользу этого метода лечения пищевой аллергии. Следует назначить элиминационную диету матери с исключением всех причинных продуктов. Именно естественное вскармливание является оптимальным при пищевой аллергии у детей. Необходимо продумать способы, позволяющие избежать случайный прием, вдыхание или контакт с провоцирующей пищей. Врач должен также предупредить пациента о возможности перекрестных реакций (например, с молоком буйвола, козы, овцы), обеспечить полноценную диету матери и настроить ее на обязательное соблюдение диеты путем полного информирования и разъяснения необходимости данных лечебных мероприятий. Если ребенок находится на искусственном вскармливании, то необходимо перевести ребенка на аминокислотную смесь или на смесь с высокой степенью гидролиза белка. Любая попытка перевода ребенка на соевую смесь или гипоаллергенную молочную смесь следует трактовать как ошибку. Смеси на основе гидролиза сывороточных молочных белков — Nutrilon ® Пепти Аллергия, Nutrilon® Пепти ТСЦ, Фрисопеп, Альфаре. Смеси на основе гидролиза казеина — Нутрамиген, Прегестимил, Фрисопеп АС. Молочные смеси с 40% гидролизом белка (Hipp HA 1, Hipp HA 2, Humana 0-HA, Humana HA 1, Humana HA 2) используются только для профилактики у детей, у которых существует угроза формирования пищевой аллергии.
Nutrilon ® Пепти Аллергия с пребиотиками — специально разработанная смесь для питания детей, страдающих АБКМ. Она производится в соответствии с директивой FSMP 1999/21 ЕС Евросоюза в отношении лечебного питания [33] и отвечает рекомендациям ESPGHAN/ESPACI [31] и ААР [32] по лечению детей, страдающих АБКМ. Nutrilon® Пепти Аллергия применяется у детей с рождения. Белковый компонент в Nutrilon ® Пепти Аллергия представлен глубокогидролизованным сывороточным белком, при этом на долю свободных аминокислот приходится 15–20%, а на долю короткоцепочечных пептидов — 80–85%. Сывороточный белок обладает лучшим аминокислотным профилем по сравнению с казеином и значительно лучшими вкусовыми качествами. Nutrilon ® Пепти Аллергия содержит приблизительно на 50–60% меньше лактозы по сравнению с обычными смесями. Это качество смеси имеет особое значение у детей с гастроинтестинальными проявлениями пищевой аллергии, так как поражение слизистой оболочки желудочно-кишечного тракта, в частности тонкой кишки, приводит к снижению активности лактазы. Наличие в смеси комплекса пребиотиков Immunofortis способствует формированию пищевой толерантности, что доказано в ряде клинических исследований [34, 35].
Белковый компонент Nutrilon ® Пепти ТЦС представлен глубокогидролизованным сывороточным белком, что и в Nutrilon ® Пепти Аллергия. Nutrilon® Пепти ТЦС применяется у детей с синдромом мальабсорбции, нарушением всасывания жиров, воспалительными заболеваниями кишечника (болезни Крона и неспецифическом язвенном колите), множественной пищевой аллергии. Для облегчения всасывания жировой компонент в Nutrilon ® Пепти ТЦС на 50% замещен среднецепочечными триглицеридами, что особенно важно для детей с мальабсорбцией. Nutrilon ® Пепти ТЦС также содержит длинноцепочечные полиненасыщенные жирные кислоты (докозагексаеновую и арахидоновую) и обогащена нуклеотидами, играющими важную роль в регенерации поврежденных клеток кишечника.
Аминокислотные смеси и гидролизные смеси абсолютно безопасны и могут длительно использоваться в качестве заменителя коровьего молока у больных с АБКМ.
Следующей, довольно часто встречающейся ошибкой среди практикующих врачей является перевод ребенка на соевую смесь в случае выявления АБКМ. В настоящее время убедительно доказано, что в детской популяции отмечается высокая частота сенсибилизации к соевым продуктам. Кроме того, соевые смеси не предотвращают формирование сенсибилизации к аллергенам коровьего молока [36]. Соевые смеси не рекомендованы в лечении детей с АБКМ до 6 месяцев в США [37]. Соевые смеси должны быть ограничены к использованию не только за счет перекрестной сенсибилизации, но и за счет присутствия в них изофлавонов, которые могут оказать нежелательное воздействие [38, 39]. Попытка решения этой проблемы привела к созданию соевых гидролизных смесей и рисовых гидролизных смесей. Эти смеси обладают всеми преимуществами, характеризующими высокогидролизные смеси, и не содержат даже следов молочных белков. Рост, развитие, биохимические параметры сыворотки крови и толерантность к смесям у здоровых детей при кормлении экспериментальной частично гидролизной смесью на основе риса и на основе белков коровьего молока были нормальные [29]. В нашей стране эти смеси еще не зарегистрированы и не представлены на рынке лечебного питания, хотя во многих странах Европы и США активно используются.
К сожалению, и переход на молочную смесь с высокой степенью гидролиза может не привести к исчезновению симптомов АБКМ, так как и на них возможно развитие аллергической реакции. Поэтому «золотым стандартом» лечения и диагностики детей с АБКМ является перевод их на элементную смесь на основе аминокислот (Nutrilon ® Аминокислоты и Неокейт). Аминокислотные смеси произведены на основе аминокислот, без применения белка, не запускают и не поддерживают аллергическую реакцию. Аминокислотные смеси хорошо переносятся, и дети легко переходят на элементную смесь, так как она лишена горького привкуса, характерного для всех смесей с высокой степенью гидролиза белка. Nutrilon ® Аминокислоты — адаптированная смесь и может быть использована как на короткий период диагностики АБКМ, так и в качестве основной смеси для длительного вскармливания. Nutrilon ® Аминокислоты создана для полноценного вскармливания детей первого года жизни, находящихся на безмолочной элиминационной диете. Nutrilon ® Аминокислоты не содержит белок, лактозу и глютен. Состав полностью адаптирован и рассчитан на длительное вскармливание. Nutrilon ® Аминокислоты — элементное питание, и при наличии IgE-опосредованных реакций не требуется постепенного перехода с предыдущей формулы. Постепенный переход удлиняет период сенсибилизации организма ребенка. В случае IgE-независимых реакций рекомендуется постепенное введение смеси в течение 5 дней.
Показания к назначению аминокислотных смесей [40]
• Тяжелое течение аллергии (при наличии одного и более критериев):
- гастроинтестинальные симптомы;
- дерматологические симптомы;
- респираторные симптомы;
- системные реакции — анафилаксия.
• При неэффективности диетотерапии смесями на основе высокогидролизованного белка (2–4 недели применения).
• При легком и среднетяжелом течении аллергии:
- при плохой переносимости смесей на основе высокогидролизованного белка (горький вкус, отказ от приема пищи);
- мнение специалиста (соотношение цена/эффективность, наличие в льготе).
• Диагностика пищевой аллергии/аллергии к белкам коровьего молока в ситуациях, когда недоступно обычное аллерготестирование или результаты обследования могут быть противоречивы.
Абсолютным показанием для перевода ребенка на аминокислотную смесь являются анафилактические реакции на белок коровьего молока, поражения желудочно-кишечного тракта (гастроэзофагеальная рефлюксная болезнь) и синдром Хейнера. При назначении аминокислотной смеси желудочно-кишечные симптомы проходят в течение 1–3 дней [41]. Другие симптомы постепенно ослабевают и окончательно исчезают к 14-му дню [42]. Прием аминокислотной смеси приводит к значимому улучшению клинических симптомов атопического дерматита [43]. При назначении аминокислотных смесей симптомы со стороны желудочно-кишечного тракта исчезают значительно быстрее, чем при использовании гидролизных смесей [44]. При использовании аминокислотной смеси рост и прибавки веса детей значимо выше, чем при использовании смесей на основе гидролизных белков [43, 44]. Аминокислотная смесь должна использоваться для диагностики аллергии на гидролизные смеси. При аллергии на гидролизные смеси использование смеси на основе аминокислот обеспечивает безопасную альтернативу [44].
Лечение детей, страдающих гастроинтестинальными проявлениями пищевой аллергии, представляет собой сложную проблему. Отсутствие клинических проявлений заболевания, непосредственно связанных с приемом продукта, наличие не-IgE-зависимых механизмов формирования заболевания, затрудняющих лабораторное подтверждение сенсибилизации, желание лечащего врача трактовать появления симптомов поражения желудочно-кишечного тракта как сопутствующее заболевание — все это создает проблемы адекватной и своевременной диагностики и лечения аллергических поражений пищеварительного тракта.
- Rankin S. M., Conroy D. M., Williams T. J. Eotaxin and eosinophil recruitment: Implication for human disease // Mol Med Today. 2000, 6: 20.
- Hogan S. P., Rothenberg M. E., Forbes E. et al. Chemokines in eosinophil-associated gastrointestinal disorders // Curr Allergy Asthma Rep. 2004, 4: 74.
- Sicherer S. H. Clinical aspects of gastrointestinal allergy in childhood // Pediatrics. 2003; 111: 1609–1616.
- Burks A. W., James J. M., Hiegel A. et al. Atopic dermatitis and food hypersensitivity reactions // J Pediatr. 1998. 132: 132–136.
- Ortolani C., Pastorello E. A., Farioli L. et al. IgE-mediated allergy from vegetable allergens // Ann Allergy. 1993; 71: 470–476.
- Lake A. M. Food protein-induced proctitis/colitis, enteropathy, and enterocolitis of infancy. UpToDate, September 2011.
- Lake A. M., Whitington P. F., Hamilton S. R. Dietary protein induced colitis in breast-fed infants // J Pediatr. 1982; 101: 906–910.
- Jenkins H. R., Pincott J. R., Soothill J. F. et al. Food allergy: the major cause of infantile colitis // Arch Dis Child. 1984; 59: 326–329.
- Jin-Bok Hwang, Moon Ho Park, Yu Na Kang et al. Advanced Criteria for Clinicopathological Diagnosis of Food Protein-induced Proctocolitis // J Korean Med Sci. 2007; 22: 213–217.
- Winter H. S., Antonioli D. A., Fukagawa N. et al. Allergy-related proctocolitis in infants: diagnostic usefulness of rectal biopsy // Mod Pathol. 1990; 3: 5–10.
- Leinman R. E. Milk protein enteropathy after acute infectious gastroenteritis: experimental and clinical observations // J Pediatr. 1991; 118: S111–S115.
- Iyngkaran N., Yadav M., Boey C. et al. Severity and extent of upper small bowel mucosal damage in cow’s milk protein-sensitive enteropathy // J Pediatr Gastroenterol and Nutr. 1988; 8: 667–674.
- Heine R. G., Elsayed S., Hill D. J. Cow’s milk allergy in infancy // Curr Opin Allergy Clin Immunol. 2002; 2: 217–225.
- Latcham F., Merino F., Lang A. et al. A consistent pattern of minor immunodeficiency and subtle enteropathy in children with multiple food allergy // J Pediatr. 2003; 143: 39–47.
- Sampson H. A., Anderson J. A. Summary and Recommendations: Classification of Gastrointestinal Manifestations Due to Immunologic Reactions to Foods in Infants and Young Children // J of Ped Gastroenterol and Nutr. 2000, Vol. 30, Issue 1, p. S87–94.
- Liacouras C. A., Bonis P., Putnam P. E. et al. Summary of the First International Eosinophil Research Symposium // Journal of Ped gastroenterol and Nutr. 2007. 45: 370–391.
- Khan S., Orenstein S. Eosinophilic Disorders of Gastrointestinal tract. In: Gastrointestinal and Liver Disease. Pathophysiology/Diagnosis/Management. 8 th ed. 2007: 543–556.
- Spergel J. M., Beausoleil J. L., Mascarenhas M. et al. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis // J Allergy Clin Immunol. 109: 363, 2002.
- Bonis P. A. L., Furuta G. T. Clinical Manifestation and Diagnosis of Eosinophilic Esophagitis. UpToDate, January 2011.
- Dahms B. B. Reflux Esophagitis: Sequelae and Differential Diagnosis in Infants and Children Including Eosinophilic Esophagitis. In: Perspectives in Pediatric Pathology. Alimentary Tract Pathology in Infants and Children. Vol. 25: 57–72.
- Kagalwalla A. F., Sentongo T. A., Ritz S. et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis // Clin Gastroenterol Hepatol. 2006; 4: 1097.
- Markowitz J. E., Spergel J. M., Ruchelli E., Liacouras C. A. Elemental diet is an effective treatment for eosinophilic esophagitis in children and adolescents // Am J Gastroenterol. 2003; 98: 777.
- Bonis P. A. L., Furuta G. T. Treatment of Eosinophilic Esophagitis. UpToDate, Feb., 2011.
- Lee M., Hodges W. G., Huggins T. L., Lee E. L. Eosinophilic gastroenteritis // South Med J. 1996; 89: 189.
- Rothenberg M. E. Eosinophilic gastrointestinal disorders (EGID) // J Allergy Clin Immunol. 2004; 113: 11.
- Van Dellen R. G., Lewis J. C. Oral administration of cromolyn in a patient with protein-losing enteropathy, food allergy, and eosinophilic gastroenteritis // Mayo Clin Proc. 1994; 69: 441.
- Bolukbas F. F., Bolukbas C., Uzunkoy A. et al. A dramatic response to ketotifen in a case of eosinophilic gastroenteritis mimicking abdominal emergency // Dig Dis Sci. 2004; 49: 1782.
- Vandenplas Y., De Greef E., Devreker T., Hauser B. Soy infant formula: is it that bad? // Acta Paediatr. 2011, Feb; 100 (2): 162–166. doi: 10.1111/j.1651–2227.2010.02021.x. Epub 2010 Oct 13.
- World Allergy Organization (WAO). Diagnosis and Rationale for Action against Cow_s Milk Allergy (DRACMA) Guidelines // Pediatr Allergy Immunol. 2010: 21 (Suppl. 21): 1–125.
- Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID-Sponsored Expert Panel // J Allergy Clin Immunol. 2010: V. 126, № 6.
- Host A., Koletzko B., Dreborg S., Muraro A., Wahn U., Aggett P., Bresson J. L., Hernell O., Lafeber H., Michaelsen K. F., Micheil J. L., Rigo J., Weaver L., Heymans H., Strobel S., Vandenplas Y. Dietary products used in infants for treatment and prevention of food allergy. Joint Statement of ESPACI and, ESPGHAN // Arch Dis Child.1999; 81: 80–84.
- American Academy of Pediatrics. Committee on Nutrition. Hypoallergenic infant formulas // Pediatrics. 2000; 106: 346–349.
- Commission DIRECTIVE 1999/21/ЕС of 25 March 1999 on dietary foods for special medical purposes.
- Moro G., Arslanoglu S., Stahl B., Jelinek J., Wahn U., Boehm G. A mixture of prebiotics oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age // Arch of Child. 2006: 91: 814–819.
- Gruber C., van Stuijvenberg M., Mosca F., Moro G., Chirico G., Braegger C. P., Riedler J., Boehm G., Wahn U. MIPS 1 Working Group. Reduced occurrence of early atopic dermatilis because of immunoactive prebiotics among low-atopy-risk infants // J Allergy Clin immunol. 2010; 126: 791–797.
- Osborn D. A., Sinn J. Soy formula for prevention of allergy and food intolerance in infants // Cochrane Database Syst Rev. 2006; 4: CD003741
- Agostoni C., Axelsson I., Goulet O., Koletzko B., Michaelsen K. F., Puntis J., Rieu D., Rigo J., Shamir R., Szajewska H., Turck D. Soy protein infant formulae and follow-on formulae: a commentary by the ESPGHAN Committee on Nutrition // J Pediatr Gastroenterol Nutr. 2006; 42: 352–361.
- Bhatia J., Greer F. American Academy of Pediatrics Committee on Nutrition. Use of soy-protein based formulas in infant feeding // Pediatrics. 2008; 121: 1062–1068.
- Vandenplas Y., De Greef E., Devreker T., Hauser B. Soy infant formula: is it that bad? // Acta Paediatr. 2011, Feb; 100 (2): 162–166. doi: 10.1111/ j.1651–2227.2010.02021.x. Epub 2010 Oct 13.
- Vandenplas Y. et al. Guidelines for the diagnosis and management of cow’s milk protein allergy in infants // Arch Dis Child. 2007; 92: 902–908.
- De Boissieu D., Dupont C. Allergy to extensively hydrolyzed cow’s milk proteins in infants: safety and duration of amino acid-based formula // J Pediatr. 2002, Aug; 141 (2): 271–273.
- Vanderhoof J. A. et al. Intolerance to protein hydrolysate infant formulas: an under recognized cause of gastrointestinal symptoms in infants // J Pediatr. 1997; 131: 741–744.
- Niggemann B. et al. Prospective, controlled, multi-center study on the effect of an amino acid based formula in infants with cow’s milk allergy/intolerance and atopic dermatitis // Pediatr Allergy Immunol. 2001, Apr; 12 (2): 78–82.
- De Boissieu D. et al. Allergy to extensively hydrolyzed cow milk proteins in infants: identification and treatment with an amino acid-based formula // J Pediatr. 1997; 131: 744–777.
Г. А. Новик, доктор медицинских наук, профессор
М. А. Ткаченко, кандидат медицинских наук, доцент
Санкт-Петербургская государственная педиатрическая медицинская академия, Санкт-Петербург
Контактная информация об авторах для переписки: mtkachenko2004@yahoo.com
Диабетическая полинейропатия
Диабетической полинейропатией называется распространенное осложнение сахарного диабета. Согласно исследованиям, считается, что до четверти пациентов с данным диагнозом страдают от клинически выраженных проявлений патологии. А в бессимптомном виде болезнь выявляется практически у всех больных диабетом. Проявления полинейропатии достаточно характерны и выражаются в виде болевого синдрома стоп, голеней, парестезий, ночных судорог, расстройства чувствительности.
array(6) < ["ID"]=>string(5) «29655» [«WIDTH»]=> int(1200) [«HEIGHT»]=> int(800) [«SRC»]=> string(86) «/upload/sprint.editor/11d/img-1656060143-7064-152-4b2b5e396d6f050948297096612922cb.jpg» [«ORIGIN_SRC»]=> string(86) «/upload/sprint.editor/11d/img-1656060143-7064-152-4b2b5e396d6f050948297096612922cb.jpg» [«DESCRIPTION»]=> string(0) «» >
Что такое диабетическая полинейропатия
Диабетическая полинейропатия — это поражение периферических нервов, которое является самым распространенным осложнением сахарного диабета. Заболевание диагностировано более, чем у 75 % пациентов. Некоторые люди даже не подозревают о том, что в их организме протекает столь серьезная болезнь.
В том случае, если диагноз полинейропатия был поставлен, это означает, что диабет является причиной поражения оболочки нервных клеток. В первую очередь поражается периферическая нервная система, то есть нервы, которые прилегают к ногам, рукам, голове и туловищу. Разделяются периферические нервы на несколько видов:
- чувствительные. Бывают малыми и большими. Функция их состоит в передаче информации от кожных покровов и внутренних органов в головной мозг;
- двигательные. Необходимы для передачи информации о движениях от мозга к телу.
Заболевание проявляется такими симптомами, как болевой синдром в конечностях, ощущение ползания мурашек, жжения или покалывания, судороги икроножных мышц по ночам, снижение чувствительности кожных покровов.
Каждая форма диабетической полинейропатии отличается различной симптоматикой:
начальная стадия. Характеризуется онемением в нижних конечностях, ощущением сильного жжения и покалывания. Допускается присутствие слабой боли в стопах, суставах и икроножных мышцах. Обычно в ночное время симптомы более выражены
поздняя стадия. Наблюдается сильнейшая боль в нижних конечностях, которая может возникать даже в состоянии покоя, мышечная слабость, сенсорные нарушения, атрофия мускулатуры и изменение пигментации кожных покровов. В процессе развития болезни многократно ухудшается состояние ногтевой пластины, она становится более ломкой или утолщается. Также у пациента формируется диабетическая стопа, то есть она увеличивается в размере, появляется плоскостопие, деформируется голеностоп и развивается нейропатический отек
токсичная и алкогольная. Для данной формы характерны следующие симптомы, которые ярко выражаются: судороги, онемение конечностей, вегетативное нарушение чувствительности стоп, ухудшение мускулатурных рефлексов, уменьшение волосяного покрова и снижение температуры конечностей, которая никак не зависит от кровотока. Вследствие этого образуется повышенная отечность и трофические язвы
диабетическая энцефалополинейропатия. Довольно нетипичная форма, так как сопровождается следующими признаками: головной болью, которая долго не проходит, постоянным чувством усталости, повышенной утомляемостью
Если длительное время не лечить токсическую или алкогольную форму болезни, то закончится она может парезом или даже параличом нижних конечностей.
Полинейропатия поражает оба отдела периферической нервной системы человека — соматический и вегетативный. Зачастую этот тип патологии поражает нижние конечности, гораздо реже верхние. На первой стадии характерных проявлений заболевания не наблюдается. Может снизиться чувствительность кожных покровов, повышаться температура тела, возникнуть несильная боли, тремор.
Вторая стадия характеризуется сильными болями по всему телу, покалыванием, онемением конечностей. На последней стадии появляются жжение, боль прогрессирует особенно в ночное время суток, у больного появляются язвы на коже, которые в результате могут привести к ампутации конечности.

array(6) < ["ID"]=>string(5) «29656» [«WIDTH»]=> int(1000) [«HEIGHT»]=> int(667) [«SRC»]=> string(86) «/upload/sprint.editor/627/img-1656060253-3852-575-78b824d3ee63b8e0b471c9c96a1e72dc.jpg» [«ORIGIN_SRC»]=> string(86) «/upload/sprint.editor/627/img-1656060253-3852-575-78b824d3ee63b8e0b471c9c96a1e72dc.jpg» [«DESCRIPTION»]=> string(0) «» >
Причины диабетической полинейропатии
Главная причина возникновения полинейропатии при сахарном диабете — это повышенный уровень глюкозы в крови. Прогрессирование заболевания можно замедлить только посредством тщательного контроля уровня сахара и при помощи адекватной инсулинотерапии (у пациентов с сахарным диабетом первого типа) или лечением такой группой медикаментов, как сульфонилмочевина (у больных диабетом, зависимым от инсулина).
При болезни в первую очередь страдает нервная система, так как именно самые мелкие кровеносные сосуды питают нервные волокна. При длительном воздействии углеводов возникает нарушение питания нервов. В результате наступает гипоксия и проявляются первичные поражения, то есть симптомы заболевания.
Первые признаки диабетической полинейропатии.
К первым признакам диабетической полинейропатии относятся:
- онемение в нижних конечностях;
- отеки в стопах и ногах;
- сильнейший болевой синдром в мышцах и суставах;
- колющее ощущение;
- мышечная слабость;
- расстройства двигательных волокон;
- снижение чувствительности в конечностях.
Остались вопросы? Мы вам перезвоним

array(6) < ["ID"]=>string(5) «29657» [«WIDTH»]=> int(600) [«HEIGHT»]=> int(400) [«SRC»]=> string(115) «/upload/sprint.editor/e2b/img-1656060555-0551-781-img-1615462569-6938-906-dizayn-bez-nazvaniya-%2815%29-%281%29.png» [«ORIGIN_SRC»]=> string(115) «/upload/sprint.editor/e2b/img-1656060555-0551-781-img-1615462569-6938-906-dizayn-bez-nazvaniya-%2815%29-%281%29.png» [«DESCRIPTION»]=> string(0) «» >
Мы с радостью проконсультируем вас и ответим на все интересующие вопросы.
Симптомы диабетической полинейропатии
У пациентов с диабетом чаще всего диагностируют сенсомоторный вид диабетической полинейропатии, при котором обычно затрагиваются чувствительные длинные нервы, которые идут к стопам и кистями. Именно поэтому первые симптомы возникают в нижних конечностях. Постепенно в патологический процесс включаются и малые нервные сенсорные волокна, симптомами поражения которых являются:
ощущение покалывания или жжения
потеря чувствительности кожных покровов к перепадам температуры
болевой синдром, возникающий ночью
чувство зябкости в кистях и стопах
покраснения кожных покровов
незаживающие раны или язвы
Поражения длинных волокон характеризуются:
- повышенной чувствительностью кожных покровов;
- проблемами с координацией;
- потерей чувства равновесия;
- изменениями в суставах;
- ухудшением двигательных способностей пальцев.
При повреждении чувствительных нервов возникает полная или частичная потеря ощущений в конечностях. Пострадавший не испытывает болей при порезах, переохлаждении, ожогах и прочих травмах. В итоге могут развиться язвы, а в том случае, если в них проникнет инфекция, возможно заражение и гангрена. В такой ситуации выход один — ампутация части пораженной конечности.
При обширном нервном и моторном поражении пострадавшие могут ощущать похолодание или зябкость в конечностях, при этом чувство не зависит от температуры окружающей среды. При поражении малых волокон человек перестает различать горячее и холодное, что многократно повышает риск ожогов и обморожений. Наиболее распространенным симптомом диабетической полинейропатии, а зачастую и единственным, является ощущение онемения в нижних конечностях.
Когда поражены длинные нервные волокна, человек не ощущает собственные движения пальцами и прикосновения. Помимо этого, могут возникнуть проблемы с равновесием и координацией в пространстве, особенно трудности заметны при перемещении в темноте или полумраке.
Если поражаются двигательные нервы, то мышцы пациента уменьшаются в объеме и ослабевают. Однако это далеко не первые симптомы диабетической полинейропатии.
Диагностика диабетической полинейропатии
Обычно диабетическую полинейропатию диагностируют на основании жалоб пациента и симптомов, однако, даже если они отсутствуют, это не значит, что у больного нет заболевания и лечение не нужно. Опытные доктора знают, что обычно болезнь протекает бессимптомно.
Люди с диабетом должны проходить обследования на диабетическую полинейропатию один раз в год, даже если нет никаких жалоб. В том случае, если подозрения на заболевание присутствуют, диагностика должна проходить не реже, чем один раз в полгода. Регулярные исследования необходимы для того, чтобы выявить болезнь на ранней стадии и подобрать адекватное лечение.
Так как один метод исследования не может показать полную картину, то для диагностики применяется сразу несколько видов:
Обычно зрительная методика включает в себя осмотр у терапевта, эндокринолога, невролога и хирурга.
Врачи изучают внешние симптомы:
- уровень кровяного давления в нижних конечностях;
- чувствительность кожных покровов;
- присутствие необходимых рефлексов;
- диагностика отечности;
- изучение состояния кожи.
Лабораторные исследования включают в себя:
- анализ мочи;
- определение концентрации глюкозы в плазме крови;
- выявление уровня холестерина;
- определение уровня токсических веществ, которые находятся в организме.
Инструментальная диагностика включает в себя всего несколько анализов:
Большая часть пациентов не предъявляют никаких жалоб при осмотре. Так как симптомы являются достаточно распространенными, многие пострадавшие попросту не обращают на них внимания.
array(6) < ["ID"]=>string(5) «29658» [«WIDTH»]=> int(1200) [«HEIGHT»]=> int(527) [«SRC»]=> string(88) «/upload/sprint.editor/a57/img-1656060978-6373-197-doctor-testing-sensibility-of-foot.jpg» [«ORIGIN_SRC»]=> string(88) «/upload/sprint.editor/a57/img-1656060978-6373-197-doctor-testing-sensibility-of-foot.jpg» [«DESCRIPTION»]=> string(0) «» >
Лечение диабетической полинейропатии
Стоит учитывать, что для успешного лечения диабетической полинейропатии необходимо удерживать сахар в плазме крови на нормальном уровне. Хоть это и не является абсолютной гарантией, что заболевание не будет развиваться дальше, так как существуют и другие факторы риска, к которым относятся:
- возраст пациента;
- соотношение массы тела к росту;
- частота употребления алкоголя;
- курение.
Во время лечения заболевания необходимо ежедневно осматривать стопы и предотвращать возможность повреждения кожных покровов. Для этого рекомендуется:
- носить мягкую удобную свободную обувь;
- не ходить по полу босиком;
- при наличии повреждений кожи обращаться к врачу или применять заживляющие препараты, назначенные лечащим доктором.
Сухую кожу с трещинами необходимо каждый день очищать и обрабатывать специальными кремами.
Стоит помнить, что курс лечения должен быть комплексным и смешанным. Он обязательно включает в себя определенные группы лекарственных препаратов, направленные на все области развития процесса. Максимально важно, чтобы лечение диабетической полинейропатии включало в себя прием препаратов, среди которых:
- витамины. Должны поступать с продуктами питания, но в ходе течения заболевания скорость и количество их усвоения уменьшается. Поэтому и необходим дополнительный прием. Благодаря витаминам улучшается передача импульсов по нервным волокнам, а также они блокируют негативный эффект глюкозы на нервную систему;
- обезболивающие вещества;
- антибиотики. Необходимы только в том случае, когда может возникнуть риск развития гангрены. Чтобы не допустить поражения тканей, лучше заранее уничтожить инфекцию;
- ингибиторы альдозоредуктазы. Вещество препятствует одному из путей трансформирования глюкозы в крови, тем самым уменьшая ее пагубное воздействие на нервные окончания;
- антигипоксанты. Способствуют использованию глюкозы в организме, улучшают циркуляцию крови в капиллярах, артериях и венах, подпитывающих нервные клетки, а также препятствуют отмиранию нервов.
Мнение эксперта
Врач-невролог, доктор медицинских наук
Избыток глюкозы в крови на протяжении длительного периода времени разрушительно действует на нервную систему. Диабетическая дистальная полинейропатия является тяжелым осложнением сахарного диабета, при котором поражаются сразу несколько крупных нервных узлов, отвечающих за функционирование нижних конечностей. Периферическая нервная система делится на соматическую и автономную. Соответственно и клиническая картина заболевания может быть разной. Наиболее опасна для жизни человека вегетативная полинейропатия, нередко в запущенных стадиях она приводит к проблемам с мочеиспусканием, потенцией, функциями сердца и сосудов, летальному исходу.
При поражении соматической нервной системы на коже нижних конечностей появляются трофические язвы. Существует еще один тип болезни — смешанный или сенсомоторный. В данном случае поражается малоберцовый нерв, и больные теряют чувствительность стоп и голени, теряют способность ими управлять.
Диабетическая дистальная полинейропатия развивается в результате серьезных эндокринных расстройств, тяжелых патологий печени и почек, депрессивных состояний, инфекционных поражений нервов и тканей, злоупотребления алкоголем, интоксикации, опухолевых процессов в организме. Врачи Юсуповской клиники проведут комплексное обследование, и выявят точный диагноз. В соответствии с клинической картиной болезни назначат комплексное лечение.
Пациенту во время лечения необходимо обеспечить максимально комфортные условия и во всем поддерживать в быту. Не менее важно обеспечить полную безопасность даже в мелочах. Например:
- контролировать температуру воды в ванной, чтобы не допустить ожога кожных покровов;
- очищать регулярно обувь и проверять ее целостность;
- оберегать ступни от чрезмерного сдавливания;
- проверять ежедневно целостность кожных покровов, которые могут повредиться попавшими внутрь обуви объектами или сдавливанием.
array(6) < ["ID"]=>string(5) «29659» [«WIDTH»]=> int(1200) [«HEIGHT»]=> int(800) [«SRC»]=> string(65) «/upload/sprint.editor/2ca/img-1656061237-9862-181-osmotr-nogi.jpg» [«ORIGIN_SRC»]=> string(65) «/upload/sprint.editor/2ca/img-1656061237-9862-181-osmotr-nogi.jpg» [«DESCRIPTION»]=> string(0) «» >
Какой вид диабетической полинейропатии есть еще
Дистальная диабетическая полинейропатия — это распространенное осложнение сахарного диабета. Считается, что более четверти больных страдают клинически выраженной формой диабетической полинейропатии, а в бессимптомной форме, которая выявляется только при помощи электромиографии, заболевание присутствует у всех пациентов с диабетом.
Главной причиной развития дистальной полинейропатии при сахарном диабете является длительное повышение уровня глюкозы в плазме крови. Поэтому единственный действенный способ замедлить прогрессирование диабетической полинейропатии — тщательный контроль уровня сахара в крови и адекватная инсулинотерапия или лечение препаратами сульфонилмочевины, что эффективно для больных инсулиннезависимым диабетом.
Симметричная сенсомоторная дистальная полинейропатия, которая также называется диабетической полинейропатией, является самым популярным клиническим проявлением поражения нервной системы.
Диабетическая дистальная сенсорная полинейропатия нижних конечностей характеризуется повреждениями ряда нервных волокон, которые ответственны за двигательные и чувствительные функции стопы:
Основными признаками, позволяющими причислить пациента к группе риска развития дистальной диабетической полинейропатии, являются:
- длительность сахарного диабета более 5-ти лет;
- осложнения на капиллярах сетчатки глаза;
- избыточная масса тела;
- гипертония;
- ишемическая болезнь сердечной мышцы;
- наследственная предрасположенность к диабетической полинейропатии;
- повышенный уровень холестерина, липопротеинов в крови и альбумина в моче.
На частоту возникновения болезни не влияет тип сахарного диабета.
Периферическая нервная система делится на соматическую и автономную. Соответственно и клиническая картина заболевания может быть разной. Наиболее опасна для жизни человека вегетативная полинейропатия, нередко в запущенных стадиях она приводит к проблемам с мочеиспусканием, потенцией, функциями сердца и сосудов, летальному исходу.
При поражении соматической нервной системы на коже нижних конечностей появляются трофические язвы. Существует еще один тип болезни — смешанный или сенсомоторный. В данном случае поражается малоберцовый нерв, и больные теряют чувствительность стоп и голени, теряют способность ими управлять.
Диабетическая дистальная полинейропатия относится к обменным нарушениям нервной системы. Особое значение при развитии осложнений имеют сосудистые факторы:
- недостаточное кровоснабжение нервных окончаний из-за повреждений сосудов;
- тромбоз;
- микроангиопатия.
К факторам, которые увеличивают вероятность возникновения заболевания, относятся:
- длительное течение сахарного диабета;
- возраст пациента старше 50-ти лет;
- гипергликемия;
- гиперлипидемия;
- артериальная гипертензия;
- регулярное употребление спиртных напитков;
- ожирение;
- курение.
Чем дольше в крови сохраняется высокий уровень сахара, тем больше вероятность развития дистальной диабетической полинейропатии и тем тяжелее будет ее течение.
К дополнительным факторам риска относится курение. Так как повышается сердцебиение, табачный дым пагубно влияет на состояние организма в целом.
Заболевание в первую очередь дифференцируется с полинейропатией, которая вызвана иными причинами:
- инфекциями, попавшими в организм;
- токсическими отравлениями;
- алкоголизмом;
- болезнями щитовидной железы;
- длительным авитаминозом;
- онкологическими заболеваниями;
- патологиями аутоиммунной системы.
В субклинической, то есть в самой ранней стадии болезнь абсолютно не беспокоит пострадавшего. Однако, при неврологическом осмотре, опытный доктор выявит следующие признаки первичного поражения:
- снижение тактильной чувствительности кожных покровов стопы;
- нарушение глубоких сухожильных рефлексов.
По мере развития заболевания наступает клиническая фаза, которая сопровождается внешними проявлениями. К первым признакам ранней стадии относятся:
- уменьшение чувствительности кожи ног к температуре;
- ощущение ползания мурашек;
- покалывание;
- жжение;
- увеличенная чувствительность к незначительным касаниям;
- судороги;
- болевой синдром различной интенсивности и характера.
Основные симптомы заболевания начинают проявляться уже тогда, когда патологический процесс привел к необратимым изменениям в организме. Поражение нервных волокон сопровождается следующей симптоматикой:
- истощением кожных покровов;
- сухостью кожи стоп;
- атрофией мышечных тканей;
- возникновением нароста в области сустава большого пальца;
- нарушением координации;
- парезами;
- неустойчивой походкой.
При подозрении на диабетическую полинейропатию сенсорной формы определяется порядок исследования и комплекс диагностических процедур. Основными направлениями диагностики являются:
- осмотр эндокринолога;
- полный лабораторный анализ крови;
- оценка состояния сердечно-сосудистой системы посредством эхокардиограммы или электрокардиограммы;
- исследование нервных рефлексов;
- диагностика органов желудочно-кишечного тракта при помощи ультразвукового исследования, рентгенографии, эзофагогастродуоденоскопии и т. д.;
- обследование мочевыводящих путей, то есть УЗИ, урография, анализ мочи или цистоскопия.
По показаниям может понадобиться консультация профильных специалистов, таких как кардиолог или дерматолог, а также проведение биопсии тканей икроножного нерва или кожных покровов.
Зачастую заболевание диагностируется на основании жалоб пострадавшего. Но даже если больной диабетом не замечает симптомов, это не значит, что болезнь отсутствует. Опытный терапевт знает, что более чем в половине случаев недуг протекает без симптомов. Именно поэтому для точной оценки состояния назначаются дополнительные исследования. Полинейропатию хронической формы, протекающую бессимптомно, можно определить двумя способами:
Пациенты с диагностированным диабетом в обязательном порядке должны проходить регулярные исследования на диабетическую полинейропатию, хотя бы один раз в год и даже в том случае, если жалобы отсутствуют.
Обычно единственный метод исследования не эффективен, потому что он не может показать полную картину, поэтому применяется сразу несколько видов диагностики:
- зрительная. Состоит из осмотра терапевта, невролога, эндокринолога и хирурга. Специалисты изучают чувствительность кожных покровов, присутствие необходимых рефлексов, состояние кожи, уровень кровяного давления в сосудах нижних конечностей;
- инструментальная. Включает в себя биопсию нервов, электронейромиографию и магнитно-резонансную томографию;
- лабораторная. Представляет собой целый набор исследований: анализ мочи, определение уровня сахара в плазме крови, выявление концентрации холестерина, определение токсических веществ, находящихся в организме.
Обязательным условием эффективной терапии диабетической дистальной полинейропатии является нормализация уровня глюкозы в организме пострадавшего. Именно с этой целью назначается специфическая терапия, например инсулином, и постоянный контроль содержания сахара в плазме крови.
Благодаря поддержанию оптимального уровня сахара можно замедлить или полностью остановить дегенеративные изменения нервной системы. За счет ранней диагностики периферической или автономной диабетической полинейропатии обеспечивается благоприятный прогноз при лечении. Важно знать, что запущенная диабетическая дистальная нейропатия — это один из главных факторов риска в развитии аритмии, инфаркта миокарда или других заболеваний опасных для жизни.
Существует несколько основных направлений лечения диабетической полинейропатии:
- патогенетическое. Направлено на восстановление функций нервных волокон;
- симптоматическое. Необходимо для купирования проявлений патологий.
Подобная терапия не может устранить первопричину заболевания, но она необходима для замедления прогрессирования болезни, минимизации вероятности развития осложнений, улучшения физического и эмоционального состояния пострадавшего.
Непосредственно лечение диабетической дистальной полинейропатии является консервативным и включает в себя:
- терапию медикаментами;
- физиотерапию;
- лечебные упражнения;
- диету;
- фитотерапию.
Лечение, которое включает в себя несколько видов терапии, обеспечивает лучший результат. Однако самолечением заниматься недопустимо, необходимо сначала проконсультироваться с лечащим врачом. Большинство медикаментов нуждается в тщательном подборе дозировки и компетентной оценке совместимости. Ряд лекарственных средств и методик противопоказан при сопутствующих диабетической полинейропатии заболеваниях.
Лечение проводится исключительно длительными курсами, так как эффект проявляется не сразу. Чтобы устранить боль и сопутствующие нарушения сна, ощущение тревожности, депрессию, назначают следующие группы препаратов:
- антидепрессанты;
- противосудорожные медикаменты;
- средства, снимающие аритмию;
- обезболивающие.
Лечебная гимнастика, физиотерапия и массаж способствуют снятию болевых ощущений, питанию нервных и мышечных тканей, препятствует атрофии мышц, улучшают нервно-мышечную проводимость, восстанавливают нормальный кровоток, а также увеличивают амплитуду движений. Разработаны различные методики физиолечения, например:
- терапия магнитными волнами;
- ультрафонофорез;
- электрофорез;
- грязевые ванны.
Массаж может применяться как классический, так и акупунктурный. Длительность его должна составлять от 30 до 60 минут. Плавные движения одновременно расслабляют и тонизируют мышцы, нормализуя микроциркуляцию крови.
Рекомендуется обогатить рацион витаминами и микроэлементами, которые способствуют улучшению нервно-мышечной проводимости. К ним относятся:
Источниками полезных веществ являются такие продукты питания, как:
- бобовые, то есть чечевица, горох, фасоль;
- гречневая крупа;
- семечки подсолнуха;
- отруби;
- грецкий орех, миндаль, кешью, арахис;
- помидоры;
- огурцы;
- петрушка;
- рыба и другие морепродукты.
Если заболевание не сопровождается поражением почек, то не стоит ограничивать употребление животных белков с мясом, птицей или рыбой. Так как недостаток белка только усугубляет процесс дистрофии мышечной ткани.
В случае длительного поддержания глюкозы в организме на определенном уровне, терапия полинейропатии максимально эффективна. Это особенно актуально при условии, что лечение начато на ранней стадии, так как именно в начальной фазе паталогические изменения еще полностью обратимы.
В редких случаях устойчивой ремиссии не удается добиться даже при нормализации уровня сахара. У пациентов из этой группы и у тех, кто по какой-либо причине не начал комплексное лечение, очень часто развиваются серьезнейшие осложнения, такие как:
В таких случаях нередко может возникнуть гангрена, которая влечет за собой ампутацию пораженной области.
Профилактические мероприятия, которые предупреждают развитие и рецидив диабетической полинейропатии дистального типа сенсорной формы:
- регулярный контроль уровня глюкозы в плазме крови;
- нормализация массы тела;
- исключение табакокурения, употребления спиртных напитков и наркотических веществ.
Такое заболевание, как диабетическая сенсорная дистальная полинейропатия — это тяжелое неврологическое осложнение сахарного диабета, которое сопровождается серьезным ухудшением уровня жизни больного и часто может привести к инвалидности в том случае, если пациент не получает квалифицированное лечение.
При правильно подобранном и квалифицированном лечении, соблюдении режима питания, ведении правильного образа жизни прогноз всегда для пострадавшего благоприятный. Заниматься самолечением не стоит, необходимо сразу обратиться к доктору, который проведет полную диагностику, назначит анализы и подберет терапию. Опытный специалист объяснит, как лечить диабетическую полинейропатию, поможет избавиться от опасного заболевания на ранней стадии, не дожидаясь плачевных последствий.
Лучшей профилактикой диабетической полинейропатии у больного сахарным диабетом является контроль и своевременная коррекция уровня глюкозы в крови. Не менее важно исключить употребление алкогольных напитков, наркотических веществ и курение, соблюдать правильный образ жизни и следовать строгой диете, назначенной доктором.
Пострадавшему рекомендуется избегать стрессов и эмоциональных перегрузок, прислушиваться к состоянию организма и соблюдать назначения врача. В целях профилактики рекомендуется:
Источники:
- https://clinica-paramita.ru/info/psoriaticheskij-artrit/
- https://zoostatus.ru/lechenie/bolezni/enteropatiya-s-poterey-belka
- https://www.proplan.ru/vet/zdorove/article/enteropatiya-s-poterey-belka-nachalo-konca
- https://probolezny.ru/mukoviscidoz/
- https://www.lvrach.ru/partners/nutr_pediatr/15435323
- https://yusupovs.com/articles/neurology/diabeticheskaya-polineyropatiya/

.jpg)