<p><strong><em>Статья на конкурс «био/мол/текст»:</em></strong> Бешенство — от слова «бес», и хоть это заболевание никакого отношения к чему-то сверхъ
Показания к назначению на исследование клеща, правила подготовки к сдаче исследования, расшифровка результатов анализа на исследование клеща и показатели нормы.
Показания к назначению АТ-ТПО, правила подготовки к сдаче исследования, расшифровка результатов анализа на АТ-ТПО и показатели нормы.
Показания к назначению анализа на D-димер, правила подготовки к сдаче исследования, расшифровка результатов анализа на D-димер и показатели нормы.
АТ-ТПО (антитела к тиреоидной пероксидазе, микросомальные антитела, антитела к микросомальному антигену)
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
АТ-ТПО: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания для назначения исследования
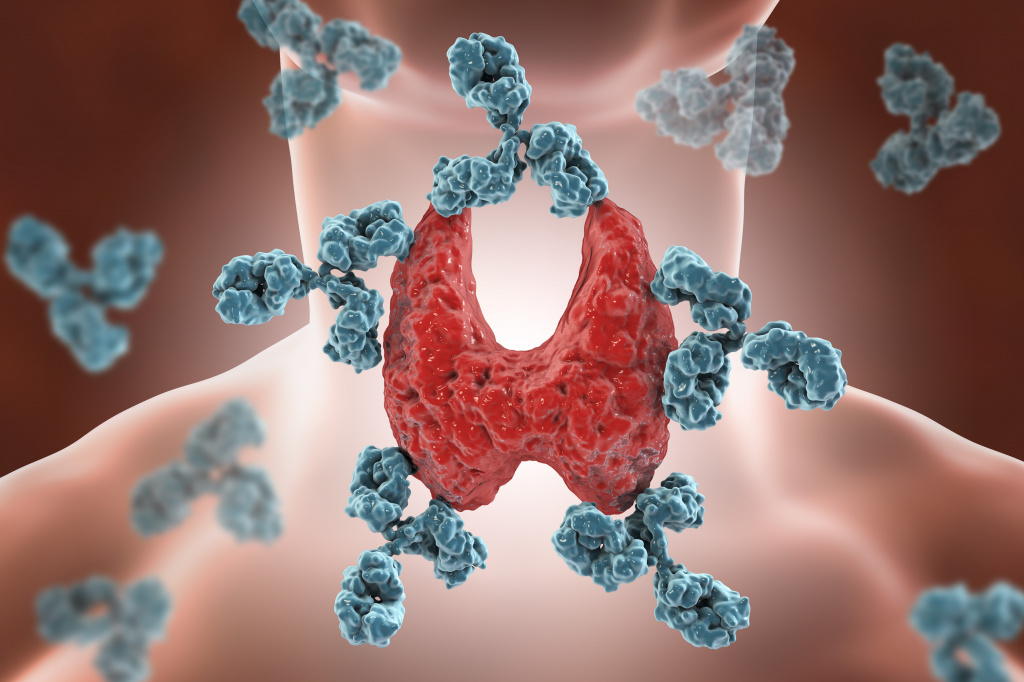
АТ-ТПО – специфические иммуноглобулины, направленные против фермента, содержащегося в клетках щитовидной железы и отвечающего за образование активной формы йода для синтеза тиреоидных гормонов. Тест назначают для установления или исключения аутоиммунной природы того или иного заболевания щитовидной железы (например, гипер- или гипотиреоза). АТ-ТПО при беременности способны проникать через плацентарный барьер из крови матери в организм плода, негативно влияя на его развитие.
Подготовка к процедуре
Анализ на определение АТ-ТПО в сыворотке крови лучше сдавать в утреннее время с соблюдением следующих правил:
- натощак, после 8-14 часов ночного периода голодания (воду пить можно);
- допустимо днем через 4 часа после легкого приема пищи;
- рекомендуется исключить физическое и эмоциональное перенапряжение за 24 часа до исследования;
- желательно прекратить прием стероидных и тиреоидных гормонов за 48 часов до исследования (по согласованию с врачом);
- не курить в течение 3 часов до исследования.
Синонимы: Анализа крови на АТ-ТПО; Антитела к микросомальному антигену; АТПО. Antimicrosomal Antibodies; Antithyroid Microsomal Antibodies; Thyroid Peroxidase Autoantibodies; TPO Antibodies; Thyroid Peroxidase Test; Thyroid microsomal antibody; Thyroperoxidase antibody; TPOAb; Anti-TPO. Краткое.
Срок исполнения
Что может повлиять на результаты
- Гемолиз при неосторожном обращении с пробой крови.
- Большое количество жиров в сыворотке крови.
- Недавние воздействия на щитовидную железу, включая:
- оперативное вмешательство;
- радиотерапию;
- лекарственную терапию (в том числе, прием тиреоидных гормонов, йодсодержащих препаратов, интерферона, амиодарона, препаратов лития, эстроген-прогестероновых препаратов или препаратов, влияющих на характер иммунного ответа).
Антитела к тиреоидной пероксидазе (в сыворотке крови)
Сдать анализ на антитела к тиреоидной пероксидазе вы можете в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Референсные границы в значительной степени зависят от применяемого метода исследования. Низкие уровни АТ-ТПО иногда обнаруживаются у практически здоровых людей. Остается неясным, может ли это отражать физиологическую норму, является ли предвестником аутоиммунного тиреоидита или проблемой специфичности метода.В целом выявление АТ-ТПО в сыворотке крови свидетельствует об аутоиммунной агрессии в отношении щитовидной железы, и чем больше результаты анализа отклоняются от нормы, тем выше вероятность наличия патологического процесса.
Пределы определения: 3 Ед/мл-1000,0 Ед/мл.
Единицы измерения в Независимой лаборатории ИНВИТРО: Ед/мл.
Повышение уровня АТ-ТПО:
- хронический тиреоидит (болезнь Хашимото);
- болезнь Грейвса (диффузный токсический зоб);
- узловой токсический зоб;
- подострый тиреоидит (тиреоидит де Кервена);
- послеродовая дисфункция щитовидной железы;
- аутоиммунный тиреоидит;
- идиопатический (с неустановленной причиной возникновения) гипотиреоз;
- умеренно повышенные уровни АТ-ТПО могут быть обнаружены у пациентов с аутоиммунными заболеваниями, не относящимися к щитовидной железе, включая ревматоидный артрит, системную красную волчанку, инсулинзависимый сахарный диабет, аутоиммунную недостаточность надпочечников и пернициозную анемию (дефицит витамина В12);
- у 7-10% здоровых людей.
- Трошина Е.А., Платонова Н.М., Панфилова Е.А., Панфилов К.О. Аналитический обзор результатов мониторинга основных эпидемиологических характеристик йододефицитных заболеваний у населения Российской Федерации за период 2009—2015 гг. Проблемы эндокринологии, 2018. 64(1): p. 21-37. doi: 10.14341/probl9308
- Бельцевич Д.Г., Ванушко В.Э., Мельниченко Г.А., Румянцев П.О., Фадеев В.В. Клинические рекомендации Российской Ассоциации Эндокринологов по диагностике и лечению (много)узлового зоба у взрослых (2015 год)//Эндокринная хирургия, 2016. 1: p. 5-13.
- Клинические рекомендации «Гипотиреоз» (взрослые). Разраб.: Российская ассоциация эндокринологов. – 2021.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Бешенство — симптомы и лечение
Что такое бешенство? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Бешенство (rabies, гидрофобия, водобоязнь) — это острое, безусловно смертельное для человека заболевание, вызываемое вирусом бешенства, который посредством специфического воспаления тканей центральной нервной системы приводит к развитию энцефалита и, как правило, к летальному исходу. Является предотвратимым при проведении своевременного курса вакцинации до (в профилактических целях) или после момента заражения.
Этиология
Вид — вирус бешенства Rabies virus:
- дикий — патогенный для человека;
- фиксированный — лабораторный, лишённый заражающей способности.
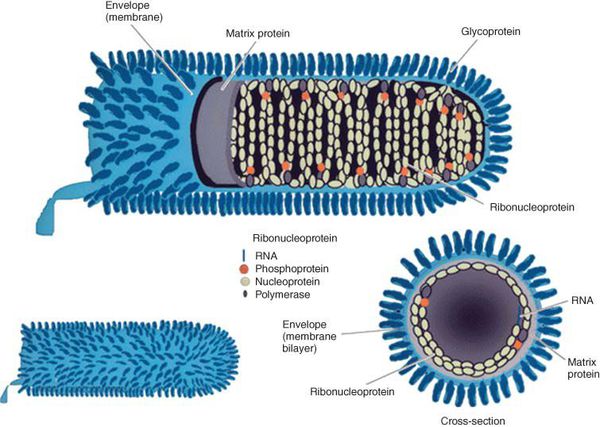
Вирус бешенства имеет вид винтовочной пули, размерами 75-175 нм, с одним плоским и другим закруглённым концами. РНК-содержащий вирус снаружи покрыт гликопротеиновым каркасом, имеющим специфические шипы (рецепторы — гликопротеин G ответственен за проникновение вируса в клетку и иммуногенность; при проведении вакцинации к нему образуются антитела, нейтрализующие вирус). Внутри содержит нуклеокапсид и матриксные белки: N-белок, L-белок, NS-белок. Различают семь серотипов вируса бешенства. В РФ распространён серотип 1.
Вирус бешенства неустойчив в окружающей среде, практически мгновенно погибает под воздействием прямых солнечных лучей, при нагревании до 60°C инактивируется в течении 10 минут, при действии различных бытовых дезинфектантов и спирта, а также при высушивании — практически мгновенно, при воздействии желудочного сока — за 20 минут.
В трупах павших животных может сохраняться до трёх месяцев. Вирус достаточно устойчив к низким температурам, (при 0°C может сохраняться несколько недель), однако при этом быстро теряет свою вирулентность — способность вызывать заболевание. При оттаивании и повторном замораживании погибает — это, в совокупности в другими факторами, обуславливает невозможность такого пути заражения.
Культивация вируса происходит посредством внутримозгового заражения лабораторных животных (белые мыши, крысы) — в таких случаях скрытый период длится до 28 дней. [1] [2] [3]
Эпидемиология
Бешенство — зоонозная природно-очаговая инфекция. Распространение практически повсеместное (исключение — Япония, Новая Зеландия, Великобритания, Австралия и Антарктида).
Какие животные переносят бешенство
Источником инфекции могут быть собаки (до 99%), лисы, летучие мыши, волки, кошки и мелкие грызуны. Любое млекопитающее и птицы могут болеть бешенством, но в подавляющем большинстве не представляют опасности для человека (например, птицы).
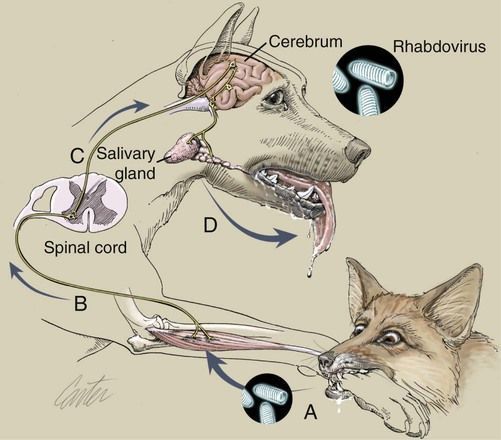
Как можно заразиться бешенством
- контактный — при укусе или ослюнении, редко возможно заражение при разделке убитого животного;
- маловероятен аэрозольный механизм заражения — например, в пещере, населённой летучими мышами;
- алиментарный — при поедании павших от бешенства животных;
- трансплацентарный путь — при передаче вируса от заражённой матери к ребёнку;
- трансплантационный путь — при пересадке органов от людей, умерших от бешенства (при неверно поставленном диагнозе).
В широкой практике вирус передаётся только через слюну, всё остальное является казуистическими случаями (при поедании животного — через мозговое вещество, при пересадке роговицы и т.п.).
Передача вируса от человека к человеку при укусе или поцелуе, при укусе мышей (кроме летучих) теоретически возможна, однако таких случаев не зарегистрировано.
Рост заболеваемости характеризуется периодичностью, зависящей от природных условий, колебаний наличия кормовой базы грызунов, численности плотоядных животных.
Заражение может наступить при:
- укусе больного животного (становится заразным за несколько дней до начала клинических проявлений — в среднем 5-7 дней, максимально до 10);
- прямом ослюнении повреждённых кожных покровов и слизистых оболочек (даже микроскопическом);
- теоретически возможно заражение при оцарапывании кожи когтями больного животного (на когтях вируса нет, но после получения царапины слюна животного может попасть в свежую рану, например, при лае).
Следует понимать, что не каждое больное бешенством животное выделяет вирус со слюной и не каждый укус передаёт человеку вирус бешенства. В среднем, при укусе животного, у которого доказано заболевание бешенством, при отсутствии антирабической вакцинации у укушенного заболевают не более 30% человек. Слюна на полу, земле, траве, пакете, дверной ручке, в реке и т.п. опасности для человека не представляет.
Восприимчивость всеобщая. Наибольшей опасности подвергаются дети, особенно в сельской местности (множество бродячих и диких животных). Ежегодно от бешенства погибает около 50 тысяч человек, в основном в Южно-Азиатском регионе.
Интересной особенностью является наличие естественного иммунитета к вирусу у холоднокровных животных и рыб. [1] [4] [5]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы бешенства
Инкубационный период бешенства составляет от 10 дней до 3 месяцев. Он зависит от локализации укуса:
- наиболее быстро заболевание развивается при укусе в лицо, шею, голову, больших повреждениях;
- более длительный период при локализации укусов в конечности, туловище, особенно единичных.
Описаны казуистические случаи скрытого периода до 1 года.
В развитии бешенства выделяют несколько периодов, последовательно сменяющих друг друга (иногда без чётко прослеживающейся динамики):
- инкубационный (10 дней — 1 год);
- продромальный (1-3 дня);
- возбуждения (2-3 дня);
- паралитический (1-3 дня).
- смерть.
После укуса формируется рубец, ничем не отличающийся от рубцов другого происхождения.
Первыми признаками бешенства у человека являются:
- зуд;
- неприятные ощущения;
- малоинтенсивные боли в месте укуса и близлежащей области;
- воспаление рубцовой ткани (происходит нечасто).
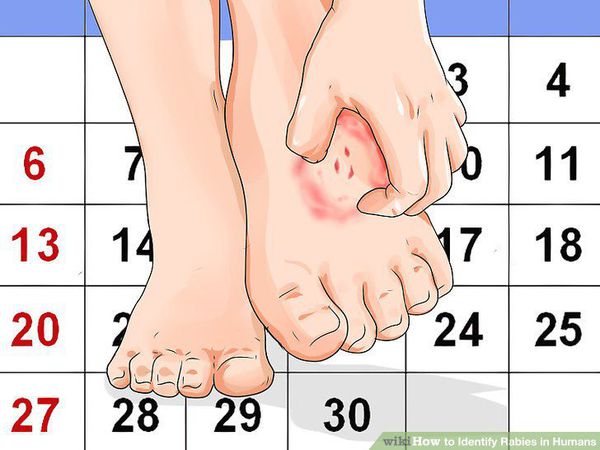
Симптомы бешенства у человека: общее недомогание, повышенная потливость, субфебрильная температура тела (37,1–38,0 °C), сухость во рту, снижение аппетита, чувство стеснения в груди. Сон больных нарушен — нередки кошмары в начале болезни, сменяющиеся бессонницей. Нарастает беспричинная тревога, беспокойство, тоска, появляется страх смерти (с нарастающим компонентом), причём выраженность данных симптомов повышается в зависимости от того, насколько сильно человек осознает возможность заболевания.
Повышается чувствительность к раздражителям (звуковым, тактильным, световым) с постепенным нарастанием их выраженности. Крайняя степень — аэрофобия, фотофобия, акустикофобия, гидрофобия — характеризуется вздрагиванием всего тела при малейшем дуновении ветра, звуках, ярком свете, судорогами мышц глотки, одышкой, вытягиванием рук вперёд, чувством страдания на лице с экзофтальмом, расширением зрачка, взглядом в одну точку в течении нескольких секунд.
Часто симптомы бешенства у людей сопровождаются икотой и рвотой. Во рту скапливается густая вязкая слюна, больной покрывается холодным липким потом, повышается ЧСС (пульс).
Часто на этом фоне при прогрессировании заболевания возникает возбуждение, больные мечутся, взывают о помощи, могут приходить в яростное состояние с помрачением сознания — дерутся, рвут одежду, могут ударить окружающих или укусить. После наступает состояние относительного покоя, сознание проясняется, и поведение становиться вполне адекватным.
Наиболее известный симптом бешенства — гидрофобия, когда при попытке выпить воды или даже при виде и мысли о воде развивается характерный судорожный приступ. В течении нескольких дней из-за невозможности пить и есть развивается обезвоживание, снижение массы тела. Начинается обильное слюноотделение, больные не сглатывают слюну, и она стекает с уголков рта и по подбородку.
Если во время одного из приступов не наступает смерть, развивается период параличей. Исчезают приступы, возбуждение и страх, больные начинают питаться и пить воду. Данное состояние можно принять за улучшение и тенденцию к выздоровлению, однако это грубое заблуждение и признак скорой смерти. Снижаются двигательные и чувствительные характеристики мышц лица, языка, конечностей. Повышается температура тела до гиперпиретических цифр (40–42°C), нарастает тахикардия, снижается артериальное давление, нарастает вялость, апатия. Смерть от бешенства неизбежно наступает от паралича дыхательного и сосудистого центров на 6-8 день болезни.

Не всегда бешенство включает все указанные периоды, иногда наблюдается выпадение продромального периода, фазы возбуждения, может наблюдаться картина восходящих параличей («тихое» бешенство) с более длинным инкубационным периодом и временем развития заболевания без типичных симптомов (часто верный диагноз не устанавливается).
Бешенство у детей имеет более короткий инкубационный период и чаще протекает в «тихой» форме без выраженного периода возбуждения.
У беременных бешенство может протекать в достаточно видоизменённой форме (часто первично принимается за токсикоз), летальность 100%, влияние на плод в настоящее время недостаточно изучено. [1] [2] [5]
Патогенез бешенства
После укуса или ослюнения повреждённого кожного покрова вирус бешенства некоторое время (до трёх недель) находится в месте внедрения. После этого начинается его центростремительное распространение в направлении центральной нервной системы (ЦНС) по периневральным пространствам со средней скоростью 3 мм/ч (аксоплазматический ток). Каких-либо значимых изменений в структуре нервной ткани не отмечается.
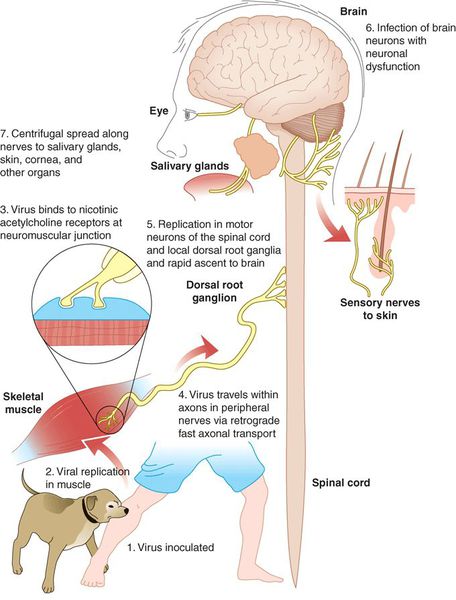
Возможно лимфогенное распространение вируса, однако роли в патогенезе и заражении это не играет.
Достигнув ЦНС вирус активно размножается в клетках (наиболее значимые области — аммонов рог, мозжечок, продолговатый мозг), где происходят воспалительно-дистрофические изменения умеренной выраженности (негнойный полиэнцефалит), обусловливающие изменение жизнедеятельности, паралитические явления и смерть (от паралича дыхательного и сосудодвигательного центров).
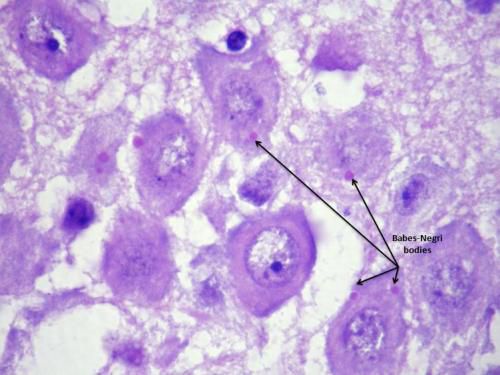
При исследовании материала мозга в цитоплазме клеток обнаруживаются специфические тельца Бабеша-Негри (цитоплазматические эозинофильные включения).
Из мозга вирус по центробежным нефронам попадает в различные органы и ткани, в том числе и слюнные железы и выделяется со слюной в окружающую среду. [1] [2] [3]
Классификация и стадии развития бешенства
- по стадиям:
- продромальная (предвестники заболевания);
- разгара (возбуждения/депрессии);
- параличей (отключение функционирования органов);
- по клиническим формам:
- бульбарная (расстройство речи, глотания, асфиксия);
- менингоэнцефалитическая (симптоматика психоза);
- паралитическая (ранее развитие параличей);
- мозжечковая (головокружение, неустойчивость походки);
- по МКБ-10:
- лесное бешенство (от диких животных);
- городское бешенство (от домашних животных);
- бешенство неуточнённое;
- по типу:
- эпизоотия (одномоментное прогрессирующее распространение заболевания среди большого количества животных) бешенства городского типа;
- эпизоотия бешенства природного типа. [3][4]
Осложнения бешенства
Ввиду быстрого наступления смерти при развитии бешенства осложнения просто не успевают развиться. [1]
Диагностика бешенства
Диагностика бешенства происходит на основании комплекса эпидемиологических и клинико-лабораторных данных. Общеклинические методы исследований малоинформативны.
Из специфических лабораторных тестов выделяют прижизненные методы и посмертные (имеют наибольшее значение). Практически все они недоступны в общелабораторной сети и выполняются только в лаборатории особо опасных инфекций (например, в антирабическом центре ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России в Москве).
- определение вирусных антигенов в отпечатках роговицы или биоптате кожи затылка методом МФА (метод флуоресцирующих антител);
- определение антител к вирусу бешенства с седьмого дня болезни (чаще всего не удаётся ввиду наступления гибели человека);
- ПЦР спинномозговой жидкости.
Посмертные диагностические методы:
- гистологический экспресс-метод мазков-отпечатков головного мозга (обнаружение телец Бабеша-Негри — достоверность около 85-90%, время выполнения до 2 часов);
- биологический метод (основанный на заражении лабораторных животных и обнаружении телец Бабеша-Негри в мозговой ткани погибших животных, достоверность до 100%, время выполнения до 30 дней);
- методы ИФА и ПЦР тканей мозга, слюны, роговицы. [2][4]
Лечение бешенства
При заражении человека и появлении начальных симптомов бешенства практически неизбежен летальный исход. В мире известно лишь о нескольких случаях излечения от развившегося бешенства (т.н. «Милуокский протокол» — введение в искусственную кому с поддержанием основных жизненных функций), однако в большинстве случаев любые методы лечения оказываются неэффективными и способны лишь незначительно продлить время жизни человека.
В целях повышения качества жизни и уменьшения страданий больного помещают в отдельную изолированную палату с минимизированными факторами внешней агрессии (затемнение, звукоизоляция, отсутствие сквозняков). Назначается комплекс лекарственных средств, направленный на уменьшение возбудимости нервной системы, дезинтоксикацию организма, поддержку дыхательной и сердечно-сосудистой функций. [1] [3]
Народные средства для лечения бешенства неэффективны, при контакте с предположительно больным животным нужно немедленно обратиться к врачу.
Прогноз. Профилактика
Основным средством предупреждения распространения и заболевания бешенством является выполнение ряда профилактических мероприятий, позволяющий снизить риски инфицирования и развития заболевания.
Выделяют мероприятия, направленные на предотвращение распространения бешенства в природе (как дикой, так и в антропургической среде):
- регуляция численности диких и одичавших домашних животных-хищников (отлов, отстрел, вакцинация);
- соблюдение правил содержания собак, кошек и пушных зверей;
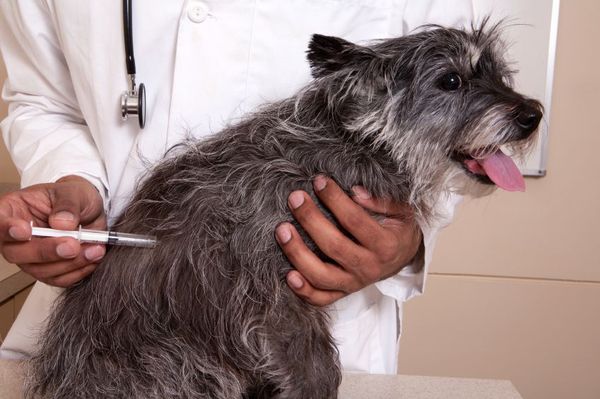
- обязательная вакцинация от бешенства домашних животных, особенно собак и кошек, профилактическая вакцинация лиц, связанных с постоянным контактом с животными;
- запрет общения домашних животных с бродячими;
- избегание прямого контакта с дикими животными, забежавшими на подворья;
- регулирование численности грызунов, являющихся кормом хищных животных.
В случае, если произошла встреча с животным и последующее прямое ослюнение им повреждённых кожных покровов (слизистых оболочек) или укус необходимо провести комплекс профилактических мероприятий, направленных на предотвращение потенциального заражения вирусом бешенства и развитие заболевания.
В первую очередь необходимо оценить и зафиксировать:
- с каким именно животным столкнулись (дикое, домашнее);
- какого его поведение (адекватное ситуации, агрессивное, излишне дружелюбное);
- есть ли возможность проводить за ним наблюдение — это очень важно: нельзя убивать или прогонять животное, так как элементарное наблюдение за поведением зверя до 10 дней от укуса позволяет исключить бешенство с вероятностью 100% (при отсутствии гибели или изменения в поведении можно спокойно выдохнуть и забыть об инциденте).
По возможности животное доставляют в ветеринарную службу для осмотра и помещения на карантин до 10 дней, при гибели животного должно быть обязательно проведено исследование на бешенство.
Постэкспозиционная профилактика
Постэкспозиционная профилактика (ПЭП) — это оказание первой помощи после контакта с предположительно заражённым животным. ПЭП позволяет предотвратить проникновение вируса в центральную нервную систему, которое неминуемо приводит к смерти.
ПЭП заключается в следующем:
- обильное промывание и местная обработка раны от укуса или царапины;
- курс иммунизации вакциной против бешенства, соответствующей стандартам Всемирной организации здравоохранения;
- при наличии показаний — введение антирабического иммуноглобулина (АИГ) [6] .
Как можно раньше после укуса необходимо промыть рану концентрированным мыльным раствором и незамедлительно обратиться в ближайшее медицинское учреждение (травматологическое отделение, антирабический кабинет) для консультации врача-рабиолога и определения показаний к проведению антирабической вакцинации и её объёму. При этом будет иметь значение наличие или отсутствие случаев бешенства в районе, принадлежность животного, его поведение, наличие профилактических прививок от бешенства, характер и локализация повреждений и др.
Достаточно распространены мифы и излишние страхи о возможности заражения в абсолютно невозможных для этого ситуациях или, напротив, преуменьшение рисков в действительно опасной ситуации. Поэтому не следует оставлять такие инциденты на самотёк, необходимо изложить все факты врачу на приёме и совместно принять верное решение.
Консультирования на заочных интернет-порталах являются хорошим начинанием, однако зачастую проводятся специалистами, не имеющими должного образования и понимания проблемы, на них невозможно оценить некоторые важные моменты, поэтому ни в коем случае не стоит подменять очную консультацию рабиолога на совет «дяди» из телевизора. Помните, что расплата за неверное решение в данном случае — смерть!
Единственным методом высокоэффективного предотвращения развития заболевания и сохранения жизни человека является вакцинация.
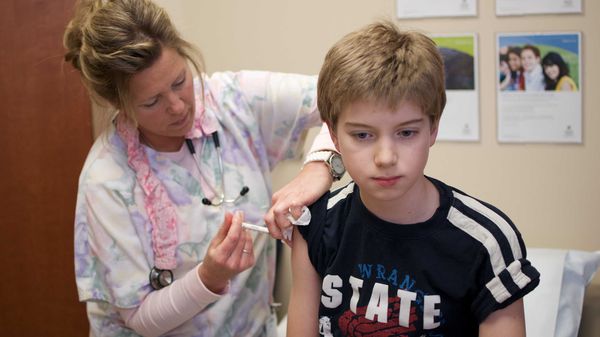
В зависимости от степени риска практикуется введение антирабического иммуноглобулина (при высоком риске) в сочетании с антирабическими вакцинами. Все вакцины от бешенства являются взаимозаменяемыми, в РФ допускается введение до шести доз вакцины, в прочих странах курс может несколько отличаться в зависимости от вакцины.
Введение вакцин должно осуществляться строго по графику, утверждённому производителем и лечащим врачом. Отход от схемы грозит нарушением выработки антител и смертью.
ПЭП зависит от степени контакта с животным, предположительно заражённым бешенством:
- если известно, что животное относится к виду, который может быть носителем или переносчиком бешенства;
- контакт произошёл в районе, в котором встречается бешенство;
- рана или слизистая оболочка загрязнена слюной животного;
- животное выглядит больным или ведёт себя нетипично;
- укус не был спровоцирован;
- животное не вакцинировано или его прививочный статус не установлен [6] .
Противопоказания к вакцинации
Не существует абсолютных противопоказаний к вакцинации от бешенства. При наличии каких-либо заболеваний и состояний, препятствующих проведению процедуры, её выполнение должно осуществляться в стационаре под контролем медицинского персонала и прикрытием противоаллергических и иных средств.
Чем раньше начат курс вакцинации, тем больше шансов на благоприятный исход ситуации, поэтому основное правильное действие после опасной ситуации — незамедлительно очно посетить врача-рабиолога, который проведёт анализ ситуации и примет ответственное решение.
Как правило, вакцинация не приводит к каким-либо негативным последствиям, наиболее выраженные из них — это умеренная болезненность и чувствительность в районе инъекции и аллергические реакции, достаточно легко купируемые соответствующими средствами.
На время вакцинации следует отказаться от чрезмерных нагрузок на организм, приёма иммунодепрессивных препаратов (при возможности), употребления алкоголя (имеют место случаи ухода в длительный запой и пропуска прививок), так как истощающие и иммунодепрессивные влияния могут ослабить выработку защитных антител и быть причиной неудачи вакцинации.
После окончания курса все ограничения снимаются, так как к этому времени происходит формирование адекватного уровня иммунитета и гибель вируса. [1] [3]
Иммуноферментный анализ
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, и приводимая ниже информация носит исключительно справочный характер.
Иммуноферментный анализ: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов.
Иммуноферментный анализ (ИФА, англ. Enzyme immunoassay, EIA) –лабораторный метод определения различных соединений (макромолекул, вирусов и пр.), в основе которого лежит реакция антиген-антитело.
Генетически чужеродные вещества, попадая в организм человека, вызывают специфические процессы, направленные на удаление этих веществ. Система организма, выполняющая данную функцию, называется иммунной системой, а сами процессы – иммунологическими.
Иммунная система представляет собой совокупность лимфоидных органов, которые функционируют согласованно за счет миграции лимфоцитов из крови в ткани и из ткани в кровь, медиаторов (посредников) и других факторов.
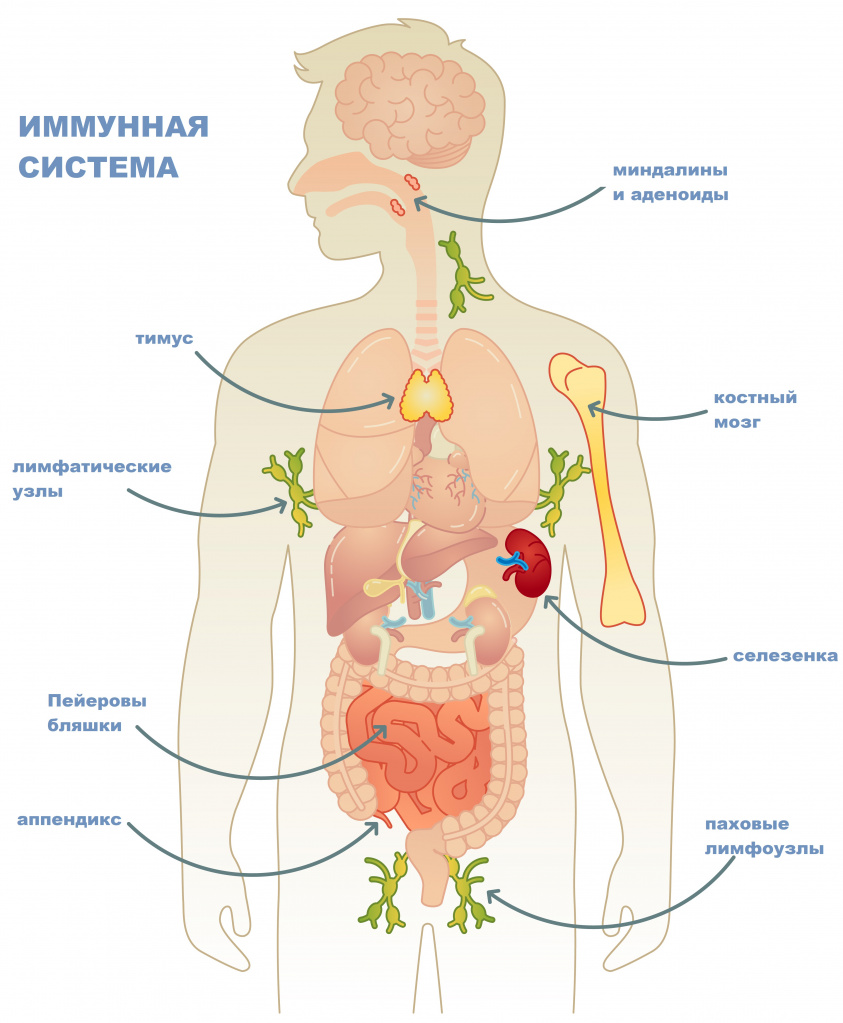
В- и Т-лимфоциты
Иммунная система слагается из центральных и периферических органов. К центральным относят тимус и костный мозг. В них лимфоциты дифференцируются (созревают) до стадии функционально активной клетки. К периферическим органам иммунной системы принадлежат лимфатические узлы, селезенка, лимфоидные структуры пищеварительного тракта, аппендикс, миндалины. В этих органах лимфоциты контактируют с антигеном, взаимодействуют между собой и с другими элементами иммунной системы.
Практически все периферические органы иммунной системы являются фильтрами или барьерами для распознавания, захвата и расщепления антигена.
Антиген (англ. antigen от antibody-generator — «производитель антител») — любое вещество, несущее признаки генетически чужеродной информации, которое организм рассматривает как чужеродное или потенциально опасное и против которого начинает вырабатывать антитела (иммунный ответ).
Способность антигенов вызывать иммунный ответ называется иммуногенностью, а способность образовывать комплексы с антителами – антигенностью.
К антигенам относятся белки, полисахариды, нуклеиновые кислоты, в том числе и в составе компонентов различных биологических структур (клеток, тканей, вирусов и т.д.).
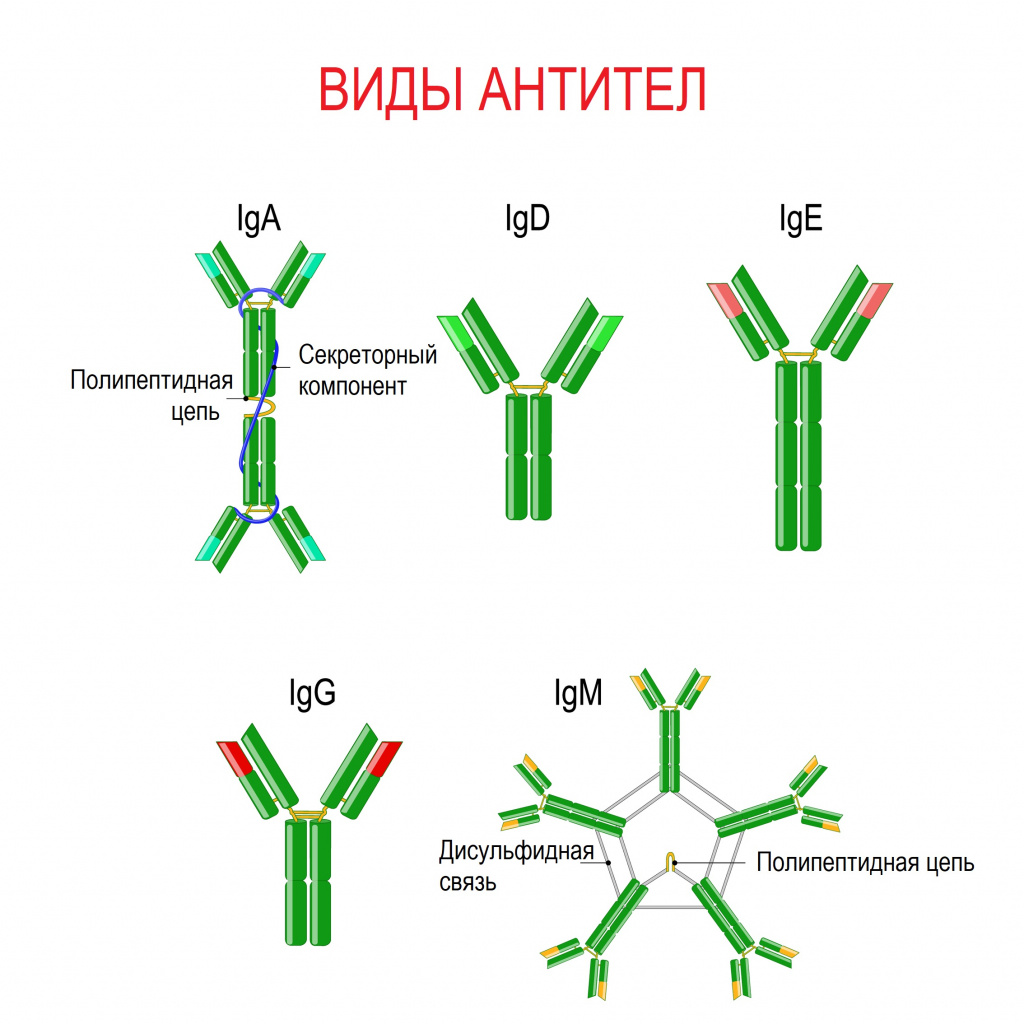
Антитела (англ. antibody) – это специальные белки иммуноглобулины (Ig), которые вырабатывает иммунная система в ответ на попадание любого чужеродного агента в организм для борьбы с ним.
Антитела обладают способностью образовывать прочные комплексы с антигенами для последующего удаления их из организма.
Иммуноглобулины (Ig) по своей химической структуре относятся к гликопротеидам (белкам, содержащим в своей структуре олигосахариды). По своим свойствам и структурным особенностям иммуноглобулины подразделяются на пять основных классов: IgA, IgD, IgE, IgG и IgM.
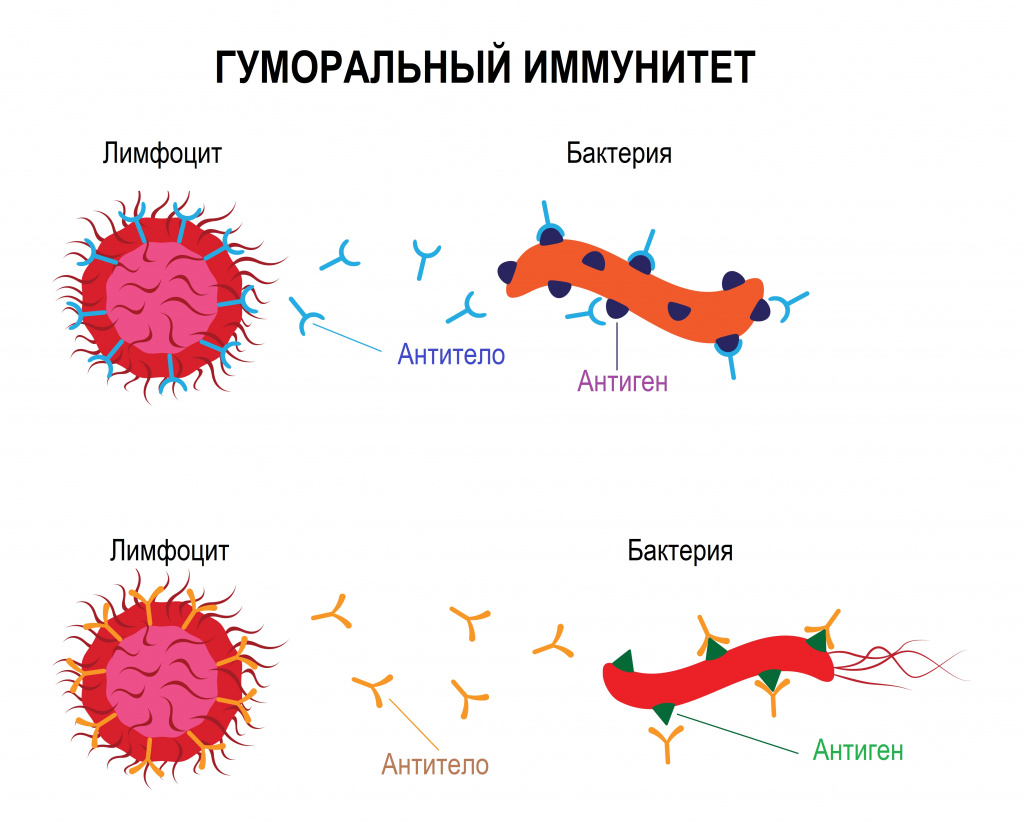
В организме антитела вырабатываются клетками крови — В-лимфоцитами. На своей поверхности эти клетки имеют рецепторы, с помощью которых они могут узнавать чужеродный антиген.
Антиген, встречаясь в кровотоке с соответствующим ему рецептором В-лимфоцита, активирует его. В-лимфоцит многократно делится и образует клон плазматических клеток. Каждый клон клеток секретирует однородные по своей структуре антитела.
Показания к проведению иммунологического обследования:
Острые и хронические бактериальные, вирусные и паразитарные инфекции (болезнь Боткина, сепсис, пневмония, лейшманиоз, туберкулез, лепра и др.), подозрение на СПИД.
Аутоиммунные заболевания (ревматическая болезнь, ревматоидный артрит, системная красная волчанка и др.).
Аллергические заболевания (бронхиальная астма, поллиноз и др.).
Злокачественные заболевания (лейкозы, лимфогрануломатоз и др.).
Кожно-венерические заболевания (контактный дерматит, пузырчатка, микоз, сифилис и др.).
Контроль цитостатической, иммунодепрессивной и иммуностимулирующей терапии.
Обследование пациентов до и после трансплантации.
Первичные иммунодефицитные состояния и др.
Постановка иммунологического диагноза складывается из следующих этапов:
- Сбор иммунологического анамнеза.
- Выявление клинических проявлений иммунопатологии.
- Иммунологические методы исследования.
В иммуноферментном анализе применяют ферменты, которые могут связывать антитела или антигены, меняют окраску специального хромогенного субстрата при взаимодействии с ним и могут быть зарегистрированы физико-химическим методом (методом спектрофотометрии, флуориметрическим, люминисцентным и др.).
На настоящий момент имеются усилительные системы, позволяющие регистрировать наличие всего нескольких сотен молекул ферментов в 1 мл раствора.
Фермент – это сложное органическое вещество, вырабатываемое живой клеткой, способствующее различным химическим реакциям, происходящим в организме.
Хромогенный субстрат – это вещество белковой природы, приобретающее определенную окраску после расщепления специфическим протеолитическим ферментом.
Фотометрический анализ — метод качественного и количественного анализа, основанный на избирательном поглощении инфракрасного, видимого или ультрафиолетового излучения молекулами определяемого компонента или его соединения с соответствующим реагентом.
При проведении иммуноферментного анализа в качестве твердой фазы используется поверхность лунок полистиролового планшета, на которую адсорбированы входящие в состав тест-системы известные антитела (против определяемого антигена).
В лунку вносят исследуемую сыворотку крови. При наличии искомого антигена он соединяется с антителом, и образуются комплексы. Лунки промывают и удаляют не связавшиеся компоненты. В лунки вносят антитела к искомому антигену, меченые ферментом. Меченые антитела присоединяются к предыдущему комплексу и также остаются на стенках. Затем в лунки добавляют специфичный для фермента субстрат (перекись водорода) и хромоген (ортофенилендиамин). Если в исследуемой жидкости был антиген, фермент взаимодействует с перекисью водорода и разлагает его. Выделившийся при этом кислород окрашивает хромоген в желтый цвет. По интенсивности окрашивания, возникающего в результате реакции фермента и субстрата, можно судить о количестве антигенов.
По аналогичной схеме работают тест-системы для определения антител, но в качестве иммуносорбента в них используются антиген, а раствор, который добавляют, содержит раствор антигенов, меченых ферментом.
В клинической диагностике с помощью фиксированных на твердой фазе антител (антигенов), определяют присутствие антигенов микроорганизмов, антител к ДНК, иммунных комплексов, антигенов раковых клеток, антител к различным видам бактерий, вирусов, простейших.
Метод ИФА может применяться для диагностики:
- Вирусных заболеваний:
- ВИЧ-инфекции;
- вирусных гепатитов;
- цитомегаловирусной инфекции;
- вируса Эпштейн-Барр;
- герпетической инфекции;
- коронавирусной болезни.
- Для диагностики инфекций, передающихся половым путем:
- сифилиса;
- хламидиоза;
- трихомониаза;
- гонореи;
- уреаплазмоза.
- Уровня гормонов в эндокринологии.
- Аутоантител и маркеров онкологических заболеваний в онкологии.
- Общего IgE и специфических IgE антител в аллергологии.
- Лекарственных препаратов, наркотиков в биологических образцах.
- Белков сыворотки крови (ферритина, фибронектина и др.).
- желательно с 7 до 9 часов утра;
- натощак, т.е. через 8-12 часов после последнего приема пищи;
- после воздержания от алкоголя не менее 24 часов;
- до проведения диагностических и лечебных процедур;
- в ряде случаев следует учитывать фазу менструального цикла, фармакодинамику лекарственных препаратов, циркадные ритмы.
- высокая чувствительность (ИФА может обнаруживать одиночные молекулы анализируемого вещества);
- возможность использования минимальных объемов исследуемого материала;
- стабильность всех ингредиентов, необходимых для проведения ИФА при хранении;
- простота проведения реакции;
- возможность автоматизации всех этапов реакции;
- относительно низкая стоимость диагностических наборов.
- при наличии ревматоидного фактора в крови, который является антителом против собственных IgG;
- при различных системных заболеваниях;
- при нарушениях обменных процессов в организме;
- при приеме некоторых лекарственных препаратов;
- у новорожденных детей.
- Л. К. Решетникова. Иммунология. – Благовещенск, 2019. — 176 с.
- Гусякова О.А. Иммуноферментный анализ: учебное пособие для студентов лечебного, педиатрического, медико-профилактического факультетов, Самара: типография Клиник ГОУ ВПО «СамГМУ Росздрава», 2010. — 32 с.
- тромбоз глубоких вен нижних конечностей;
- тромбоз подкожных вен;
- тромбоэмболию легочной артерии (ТЭЛА).
- пожилые люди;
- люди с избыточной массой тела;
- беременные женщины;
- пациенты с сердечно-сосудистыми заболеваниями (ССЗ);
- пациенты после инсульта в отделении интенсивной терапии (ОИТ);
- пациенты после обширных хирургических вмешательств, травм, ожогов;
- пациенты с онкологическими заболеваниями;
- септические пациенты.
- фибринолитическая терапия (терапия, направленная на растворение тромбов) в предшествующие 7 дней до проведения исследования;
- инфаркт миокарда;
- атеросклероз;
- сепсис, тяжелые инфекции;
- цирроз печени;
- тромботических состояний (тромбоза глубоких вен, нередко осложняющегося тромбоэмболией легочной артерии);
- ДВС-синдрома;
- осложнений течения беременности;
- постковидного синдрома.
- 5 × возраст (в единицах D-димера нг/мл DDU)
- или 10 × возраст (в альтернативных единицах фибриногена FEU нг/мл).
- при артериальных и венозных тромбозах любой локализации;
- при осложненном течении беременности;
- у пациентов старше 80 лет;
- после хирургических вмешательств;
- при онкологических заболеваниях;
- при проведении тромболитической терапии;
- при ДВС-синдроме;
- при наличии воспалительного процесса (небольшое повышение), сепсисе (значимое повышение);
- при заболеваниях печени;
- при обширных гематомах.
- при отсутствии тромботических осложнений;
- при дефиците тканевого активатора плазминогена или высокой активности ингибитора активатора плазминогена;
- у пациентов, начавших терапию антикоагулянтами;
- при малом размере кровяного сгустка;
- при «старом» тромбе (более 2 недель после образования тромба).
- вирус клещевого энцефалита (Tick-borne encephalitis Virus, TBEV)– возбудитель клещевого энцефалита;
- боррелии (Borrelia burgdorferi s.l.) – возбудитель боррелиоза – болезни Лайма;
- анаплазмы (Anaplasma phagocytophilum) – возбудитель гранулоцитарного анаплазмоза человека;
- эрлихии (Ehrlichia chaffeensis/E.muris-FL) – возбудитель эрлихиоза.
- Ген нуклеокапсидного белка N, окружающего цепь РНК.
- Ген белка NSV — одного из компонентов вирусной транскриптазы, входящего в состав капсида.
- Ген, кодирующий матриксный белок M, выстилающий липидную мембрану с внутренней стороны.
- Ген белка G — внешнего гликопротеида вирусного суперкапсида (оболочки, покрывающей капсид с внешней стороны и содержащей шипы), который отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенными и иммуногенными свойствами (антитела именно к этому гликопротеиду нейтрализуют вирус бешенства).
- Ген белка L — высокомолекулярного компонента вирусной транскриптазы [5] (рис.4).
- вирус классического бешенства — RABV;
- вирус рукокрылых Лагос — LBV;
- вирус Дювенхейдж — DUVV;
- лиссавирусы европейских рукокрылых EBLV-1 и EBLV-2;
- лиссавирус австралийских рукокрылых — ABLV;
- вирус Мокола — MOKV.
- Их выращивают не в живых существах, а в культурах клеток эмбрионов птиц, что делает процесс создания вакцины более контролируемым и гуманным.
- Они более безопасны, так как почти не вызывают побочных эффектов.
- Они экономичнее. Объем для успешной вакцинации нужен меньший, а хранить такие вакцины можно дольше.
Подготовка к процедуре
Взятие пробы для лабораторного исследования методом ИФА должно проводиться:
Пациент должен находиться в спокойном состоянии не менее 15 минут: сидя или лежа. Наложение жгута (манжеты) не должно превышать 1 мин.
Преимущества иммуноферментного анализа по сравнению с другими методами определения антигенов и антител:
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
D-димер
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
D-димеры – фрагменты молекулы фибрина, образующиеся при его распаде. Такое название они получили из-за того, что содержат два соединяющихся D-фрагмента белка фибриногена.
D-димер: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показание к назначению исследования
Повреждение сосудистой стенки запускает в организме каскад физиологических реакций, направленных на предотвращение кровотечения. Результатом этих процессов становится образование кровяного сгустка, состоящего из клеток крови и белка фибрина. В норме факторы, способствующие свертыванию крови, и факторы, препятствующие его развитию, находятся в равновесии.
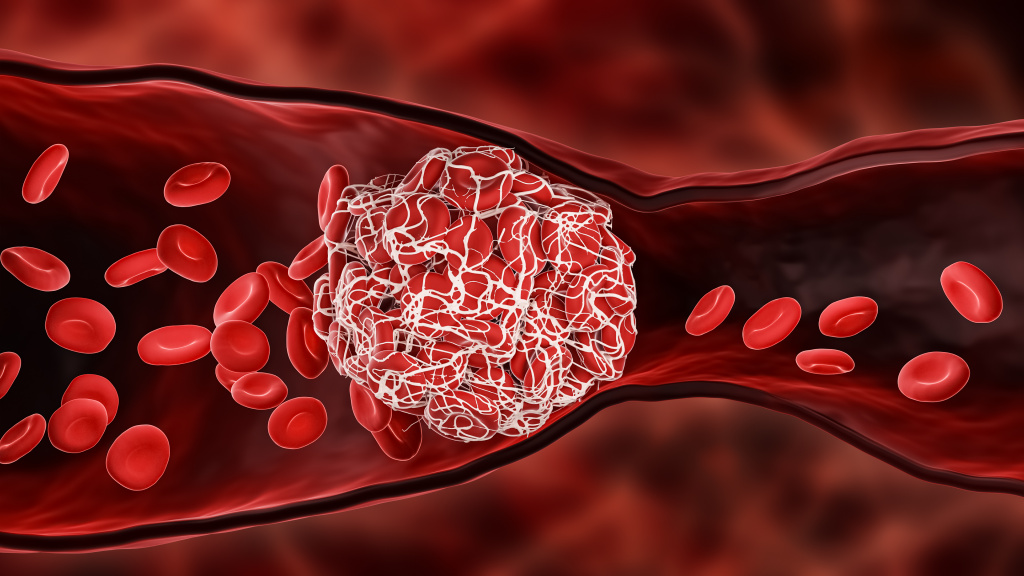
Образование сгустка крови, или тромба, блокирующего кровотечение
В результате работы фибринолитической системы происходит расщепление фибрина на более мелкие фрагменты, поэтому сгусток не распространяется от места повреждения сосуда по всему сосудистому руслу. При этом образуются разнообразные продукты деградации фибрина различной молекулярной массы, среди которых имеются и D-димеры.
Иллюстрация «Деградация фибрина»
Подпись Фрагменты молекулы фибрина, образующиеся при его распадеСодержание D-димера в крови отражает как образование фибрина, так и его растворение.
D-димер метаболизируется в почках, время его полужизни при сохранной функции почек составляет приблизительно 6-8 часов. Сбои в работе фибринолитической системы могут приводить к повышенному образованию тромбов.
Повышенный уровень D-димера в крови свидетельствует об активно протекающих процессах тромбообразования, но не позволяет судить о локализации тромба, поэтому определение уровня D-димера в плазме крови используется для исключения тромбоза любой локализации.
Пациенты с высоким уровнем D-димера нуждаются в инструментальном обследовании для подтверждения или исключения тромбоза.
Пациенты с исходно высокой концентрацией D-димера имеют примерно в 3,5 раза больший риск развития венозных тромбоэмболических осложнений (ВТЭО), чем пациенты с низкой концентрацией.
Содержание D-димера во время беременности существенно увеличивается и достигает максимума в III триместре. Данный процесс имеет физиологическое значение и направлен на уменьшение кровопотери при родах.
Высокие концентрации D-димера могут выявляться у женщин с осложнениями беременности (гестозом, преэклампсией), у беременных с сахарным диабетом и заболеваниями почек. Оценка уровня D-димера у пациенток с осложненным течением беременности в анамнезе позволяет выявить группы риска, для которых проведение антитромботической профилактики обязательно. При наличии генетической предрасположенности к тромбозам повышение уровня D-димера в I триместре беременности может свидетельствовать о высоком риске тромботических и акушерских осложнений.
ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания) характерен для сепсиса. Появление тромбов в микрососудистом русле приводит к нарушению работы органов и систем, развитию полиорганной недостаточности. Повышение уровня D-димера обнаруживают почти у 95% больных с сепсисом.
В норме уровень D-димера увеличивается с возрастом – это объясняется уменьшением почечного клиренса плазменных белков, повышением уровня фибриногена и/или присутствием скрытых и системных заболеваний.
Таким образом, определение D-димера используют для диагностики:
Подготовка к процедуре
Взятие крови предпочтительно проводить утром натощак, после 8-14 часов ночного периода голодания (воду пить можно), допустимо днем через 4 часа после легкого приема пищи.
Накануне исследования необходимо исключить повышенные психоэмоциональные и физические нагрузки (спортивные тренировки), прием алкоголя.
Срок исполнения
1 рабочий день, указанный срок обычно не включает день взятия биоматериала.
Что может повлиять на результат исследования
В случае несоблюдения правил подготовки полученный результат может быть некорректным. Кроме того, уровень D-димера меняется при приеме антикоагулянтов.
Коагулологические исследования (коагулограмма) D-димер (D-dimer)
Синонимы: Фрагмент расщепления фибрина. D-dimer, Fragment D-dimer, Fibrin degradation fragment. Краткая характеристика определяемого вещества D-димер D-димер представляет собой растворимый продукт расщепления поперечно-сшитого фибрина. Генерация D-димера требует последовательной активност.
Сдать анализ крови на D-димер можно в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
Метод определения: Иммуноанализ.
Исследуемый материал: Плазма (цитрат).
Единицы измерения: нг/мл (что соответствует нг/мл DDU, D-Dimer Unit – единицы D-димера).
Альтернативные единицы: нг/мл FEU (Fibrinogen-Equivalent Unit – единицы фибриногена).
Пересчет единиц: нг/мл FEU х 0,5 => нг/мл DDU.
Нормальные показатели
Для беременных женщин нормальные показатели уровня D-димера составляют:
в 1-ом триместре: < 286 нг/мл;
во 2-ом триместре: < 457 нг/мл;
в 3-м триместре: < 644 нг/мл.Для лиц старше 50 лет с подозрением на тромбоз глубоких вен, но его невысокой клинической вероятностью, специфичность оценок может быть повышена с использованием корректированного возрастного порога, который рассчитывается по формуле:
Расшифровка показателей
Концентрация D-димера в плазме ниже 243 нг/мл с большой долей вероятности позволяет исключить у пациентов тромботические состояния.
Повышение концентрации D-димера выше референсных значений может быть при тромбозах любой локализации, а также заболеваниях и состояниях, вызывающих повышение D-димера в крови.
Что значат повышенные показатели
Повышение показателей D-димера наблюдается:
Что значат пониженные результаты
Снижение показателей D-димера фиксируется в следующих случаях:
Дополнительные обследования при отклонении показателя от нормы
Для исключения или подтверждения тромботических осложнений D-димер не может использоваться как единственный тест. Диагностика тромбоза требует инструментального подтверждения при тромбоэмболии легочной артерии (визуализация легочных сосудов методом КТ-ангиографии), при тромбозе глубоких вен (ультразвуковое компрессионное дуплексное ангиосканирование, рентгеноконтрастная флебография, магнитно-резонансная флебография).
Программа лабораторной диагностики склонности к тромбозам может включать:
-
клинический анализ крови: общий анализ, лейкоформула, СОЭ (с обязательной «ручной» микроскопией мазка крови);
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Исследование иксодового клеща методом ПЦР на наличие возбудителей боррелиоза (болезни Лайма), вирусного клещевого энцефалита, моноцитарного эрлихиоза, гранулоцитарного анаплазмоза
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Исследование иксодового клеща: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показание к назначению исследования
Показанием для выполнения исследование является присасывание клеща к телу человека.
Для Российской Федерации наибольшее эпидемиологическое значение имеют иксодовые клещи (относящиеся семейству Ixodidae).
Для инфекций, передающихся иксодовыми клещами, характерна весенне-осенняя сезонность с апреля по октябрь, однако в регионах с теплым климатом отмечается круглогодичная активность иксодовых клещей. Группами риска по заболеваемости инфекциями, передающимися иксодовыми клещами, являются жители городской и сельской местности, посещающие очаги обитания клещей. Передача возбудителей инфекций происходит при присасывании зараженных клещей к телу человека.

К инфекциям, передающимся иксодовыми клещами, относятся клещевой вирусный энцефалит, иксодовые клещевые боррелиозы, клещевой гранулоцитарный анаплазмоз человека, моноцитарный эрлихиоз человека и другие (лихорадка Ку, крымская геморрагическая лихорадка, туляремия, риккетсиозы).
Возбудитель клещевого энцефалита — РНК-содержащий вирус рода Flavivirus. Инкубационный период заболевания составляет, как правило, 7–14 дней от момента присасывания клеща, но может длиться до 25 дней. Инфекция поражает клетки головного и спинного мозга с последующим развитием парезов и параличей.
Выявление возбудителя клещевого вирусного энцефалита в клеще позволяет своевременно провести экстренную профилактику инфекции. В случае получения положительного результата показано экстренное введение специфического иммуноглобулина — не позднее 72 часов от момента укуса. Максимальная эффективность препарата наблюдается при его введении в течение первых суток после укуса.
Возбудитель болезни Лайма — спиралевидная бактерия рода Borrelia. Заболевание развивается в 20% случаев после присасывания клеща, инфицированного боррелиями. У 50-80% больных отмечается местное кожное воспаление – клещевая мигрирующая эритема (покраснение), диаметр которой не превышает 5 см. При распространении по крови боррелии поражают внутренние органы, клетки нервной системы, в результате чего могут развиться менингит, менингоэнцефалит, радикулоневрит, неврит черепных нервов.
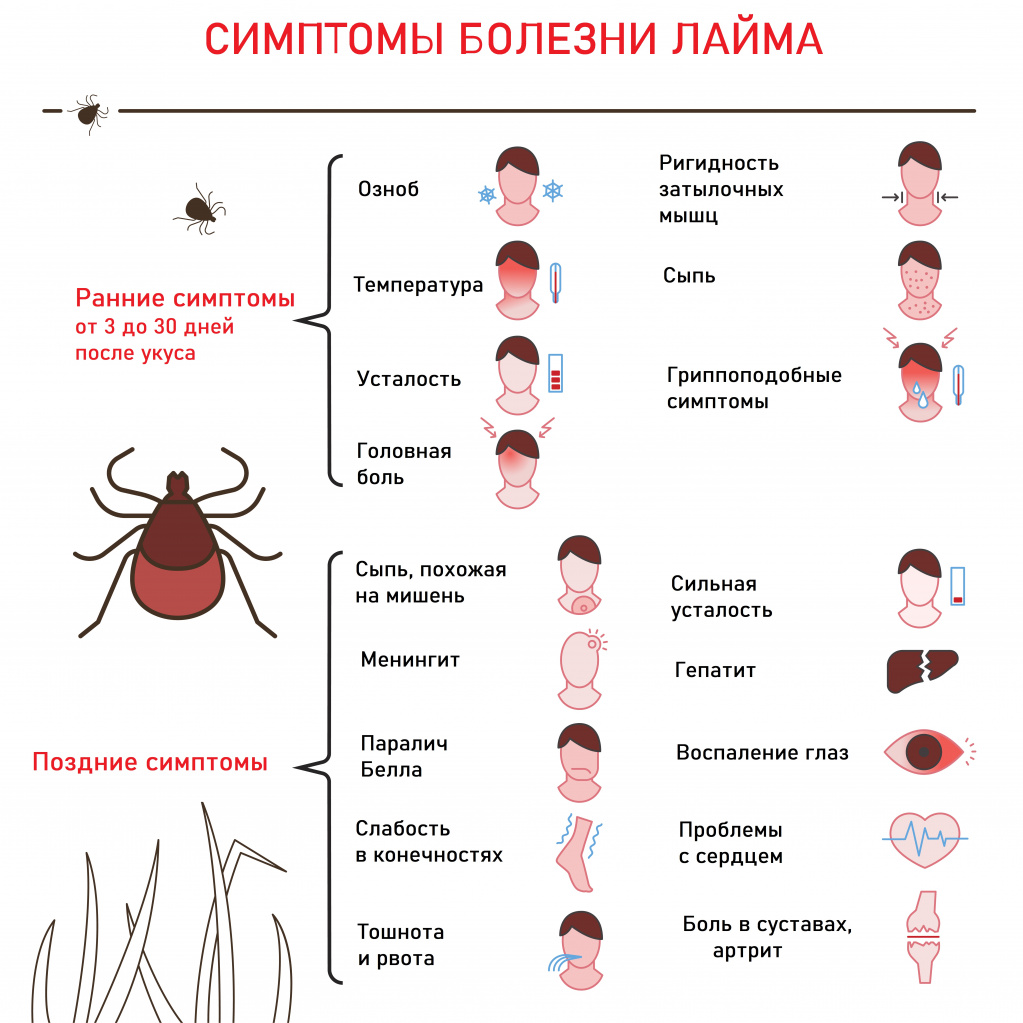
Возбудитель гранулоцитарного анаплазмоза человека — бактерия Anaplasma phagocytophilum, которая поражает гранулоциты – белые клетки крови, содержащие гранулы (нейтрофилы, эозинофилы, базофилы). Заражение происходит при укусе клеща, инфицированного бактериями — анаплазмами.
Среди симптомов заболевания отмечают длительную лихорадку, слабость, головную боль, потливость, кашель, тошноту, рвоту, диарею, боль в мышцах и суставах. Увеличиваются лимфатические узлы, могут наблюдаться поражения почек, печени, селезенки. Реже диагностируется воспаление оболочек головного и спинного мозга. Инкубационный период в среднем составляет 14 дней.
Возбудителями моноцитарного эрлихиоза являются бактерии, относящиеся к роду Ehrlichia. Они попадают в организм человека со слюной клеща, по лимфатическим путям проникают в кровь и начинают размножаться в клетках внутренней поверхности сосудов, в белых клетках крови — моноцитах. После разрушения клетки микроорганизмы выходят из нее и инфицируют другие. Поражаются внутренние органы (печень, центральная нервная система, костный мозг, кожа) с развитием инфекционных гранулем. Клиническая картина эрлихиоза схожа с гранулоцитарным анаплазмозом.
Гранулоцитарный анаплазмоз человека, моноцитарный эрлихиоз и боррелиоз являются показанием к назначению антибактериальной терапии. При своевременном выявления заболевания и лечении прогноз благоприятный.
Подготовка к процедуре
При обнаружении присосавшегося клеща для его удаления из тела необходимо обратиться в травматологический пункт. Если такой возможности нет, клеща следует удалить самостоятельно. Для этого нужно перехватить тело клеща обернутыми марлей пальцами или пинцетом строго перпендикулярно поверхности тела, как можно ближе к его ротовому аппарату. Затем, поворачивая тело клеща вокруг оси, извлечь его. Не рекомендуется смазывать место укуса и самого клеща маслом. Клеща с кусочком влажной ваты необходимо поместить в плотно закрываемую емкость (специальный контейнер с крышкой для исследования биоматериала, банку, пробирку или др.). Нельзя помещать в одну емкость клещей, снятых с разных людей.
Ранку на коже продезинфицировать антисептиком (спиртом, йодом, зеленкой), руки после извлечения клеща тщательно вымыть с мылом. Контейнер с клещом доставить в ближайший медицинский офис в день снятия. В настоящее время можно приобрести специальные устройства для удаления клеща, которые продаются в аптеке.

Клеща (в контейнере или другой емкости) необходимо доставить в медицинский офис в день снятия.
Срок исполнения
Качественные тесты («обнаружено — не обнаружено») исследования клеща для выявления РНК/ДНК возбудителей инфекций, передаваемых иксодовыми клещами: клещевого энцефалита, боррелиоза (болезни Лайма), анаплазмоза, эрлихиоза выполняются до 3 рабочих дней.
Что может повлиять на результат
Сроки выполнения ПЦР-исследований могут быть увеличены при проведении подтверждающих тестов.
Лабораторное исследование клеща для выявления РНК/ДНК возбудителей инфекций, передаваемых иксодовыми клещами: клещевого энцефалита, боррелиоза (болезни Лайма), анаплазмоза, эрлихиоза
Синонимы: ПЦР-диагностика клещевого энцефалита, боррелиоза, анаплазмоза и эрлихиоза. Tick-borne diseases, polymerase chain reaction, PCR, tick-borne encephalitis, Lyme disease, human anaplasmosis, human ehrlichiosis. Краткое описание теста «Лабораторное исследование клеща для выявления РНК.
Форма представления результата: тест качественный.
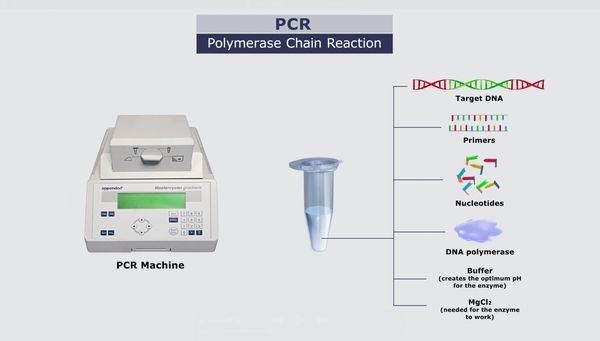
Метод определения — молекулярно-генетический (ПЦР). ПЦР (полимера́зная цепна́я реа́кция) — метод молекулярной биологии, позволяющий обнаружить малые концентрации генетического материала (определенных фрагментов РНК/ДНК) бактерий, вирусов, паразитов в биологическом материале (в крови, моче, соскобе, исследуемом клеще).
Анализ выполняется для ранней диагностики, экстренной специфической профилактики и проведения лечения заболеваний, передаваемых иксодовыми клещами.
Исследуемый материал — клещ.Сдать анализ крови на инфекции, передаваемые иксодовыми клещами можно в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
Нормальные показатели
«Не обнаружено» — не обнаружено специфических фрагментов РНК или ДНК возбудителя клещевого энцефалита или боррелиоза, анаплазмоза, эрлихиоза в теле клеща.
Расшифровка показателей
В данных исследованиях проводится выявление в клеще специфических фрагментов РНК или ДНК возбудителей инфекционных заболеваний, которые переносятся клещами:
Обнаружено: выявлены специфические фрагменты РНК или ДНК соответствующего инфекционного агента в теле клеща.
Не обнаружено: не обнаружено специфических фрагментов РНК/ДНК данного возбудителя.
При присасывании клеща на эндемичной по клещевому вирусному энцефалиту территории и/или получении положительного результата лабораторного исследования клеща необходимо срочно обратиться за медицинской помощью для принятия мер экстренной профилактики в течение 72 часов после присасывания под наблюдением врача-инфекциониста, а при его отсутствии – врача-терапевта. При появлении клинических признаков заболевания следует как можно быстрее обратиться к врачу-инфекционисту в медицинскую организацию.
Дополнительное обследование при отклонении от нормы
Если клещ не сохранился или не подлежит исследованию вследствие неправильного хранения, с целью раннего обнаружения возбудителей инфекций в организме пациента могут быть назначены следующие исследования крови:
-
антитела класса IgМ к вирусу клещевого энцефалита (количественный анализ);
Маркёр острой инфекции вирусом клещевого энцефалита. Вирус клещевого энцефалита – РНК-содержащий вирус семейства Flaviviridae. Он входит в группу арбовирусов, то есть вирусов, передающихся насекомыми. Переносчики заболевания и резервуар вируса клещевого энцефалита в природных ус.
Смертоносный кусь

Обзор
Даже домашние животные могут быть переносчиками бешенства
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Бешенство — от слова «бес», и хоть это заболевание никакого отношения к чему-то сверхъестественному не имеет, со стороны больной выглядит в лучших традициях фильмов ужасов. Что вызывает столь характерные симптомы? Почему стоит избегать общения с дикими животными? И самое главное: как не пополнить ряды безнадежно больных?

Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Стоит начать с истории
От глиняных табличек до современности
Первые упоминания о болезни от укуса собак, весьма напоминающей бешенство, встречаются на клинописных глиняных табличках Древней Месопотамии в третьем тысячелетии до н.э. [1].
Древнегреческий философ Демокрит описал бешенство собак в V веке до н.э., то же сделал и Аристотель, однако он считал, что человек бешенством не болеет. Корнелий Цельс, древнеримский ученый, в I веке н.э. все же заметил аналогичное заболевание у людей и назвал его водобоязнью [2].
Начиная с XIII века у нас появляются сведения о крупных эпизоотиях бешенства на территории Европы. Вероятно, они вспыхивали и на других континентах, так как это заболевание в современном мире распространено практически повсеместно.
Эпизоотия — эпидемия среди животных.
И если вы думаете, что это все было давно, и сейчас вирус не представляет никакой опасности, вы крупно ошибаетесь: согласно данным ВОЗ 2007 года, он ежегодно уносил жизни 55 тысяч человек по всему миру [3]. Это около 151 смерти в день! Такой постоянно высокий показатель говорит о человеческой уязвимости, эпизоотии вспыхивают каждый год, что ставит под опасность жизнь каждого человека. На данный момент случаи заражения бешенством носят регулярный характер в более чем 150 странах мира, в том числе и в России [4] (рис. 1 и 2).
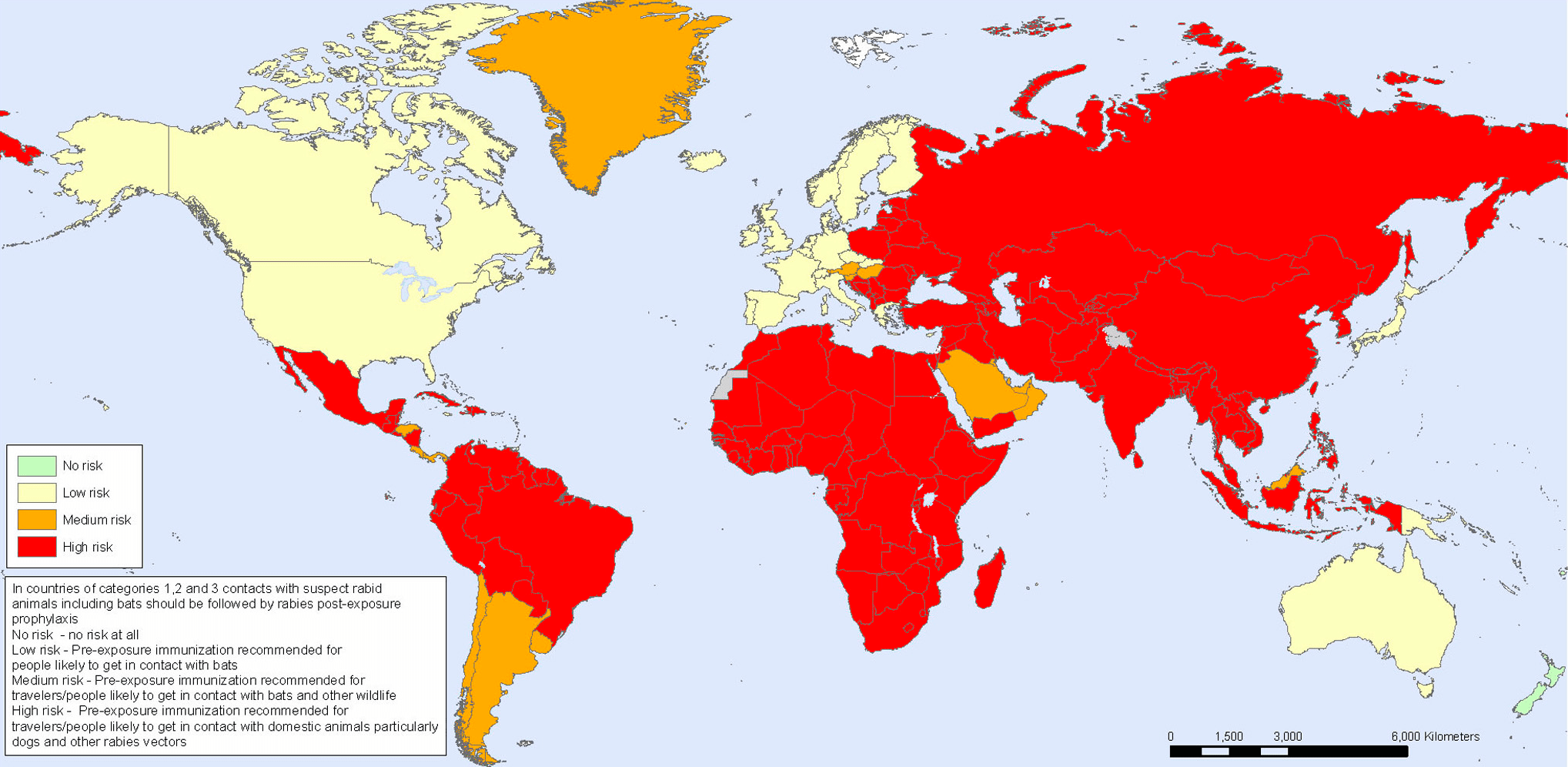
Рисунок 1. Оценка риска заражения бешенством в мире
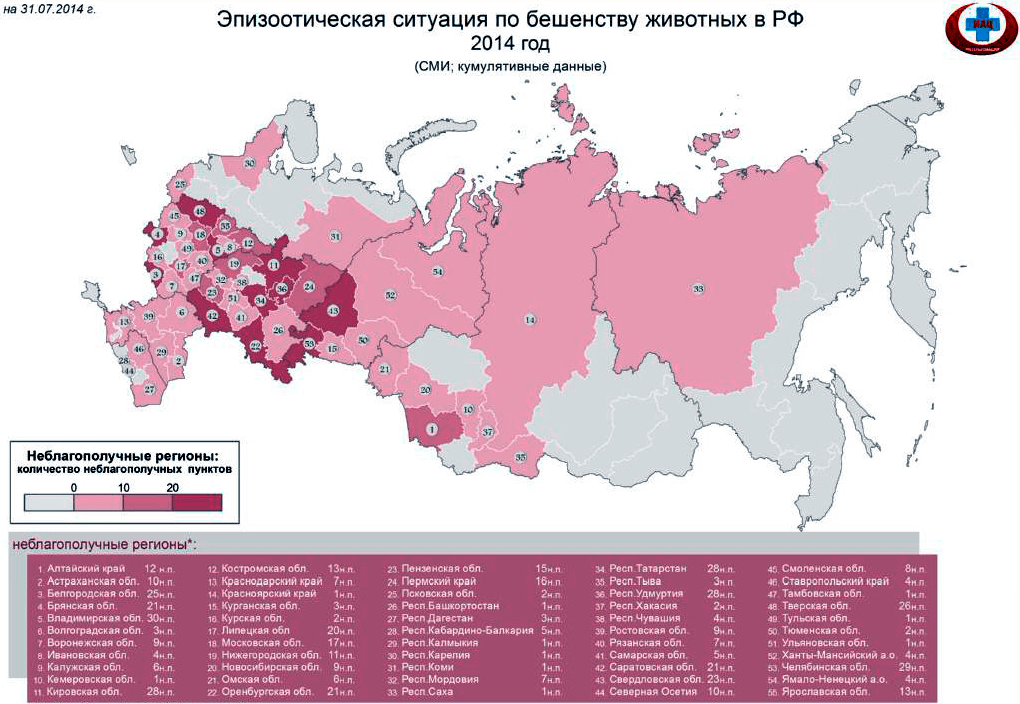
Рисунок 2. Неблагополучные по бешенству регионы России, данные 2014 года подпись
Давайте знакомиться, Neuroiyctes rabid
Что ты такое?
Бешенство (rabies, hydrofobia) — особо опасная вирусная инфекция теплокровных животных, в том числе и человека, она выбирает самое «вкусное» — центральную нервную систему (ЦНС). При отсутствии своевременного лечения это заболевание приводит к летальному исходу.
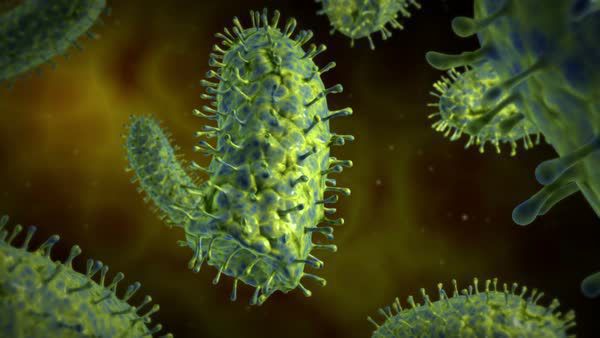
Вирус бешенства входит в отдельное семейство РНК-содержащих вирусов — Rhabdoviridae. Интересно, что такое название оно получило от греческого корня rabdos — «палочка» (рис. 3), так как все рабдовирусы имеют пулевидную или палочковидную форму [5].
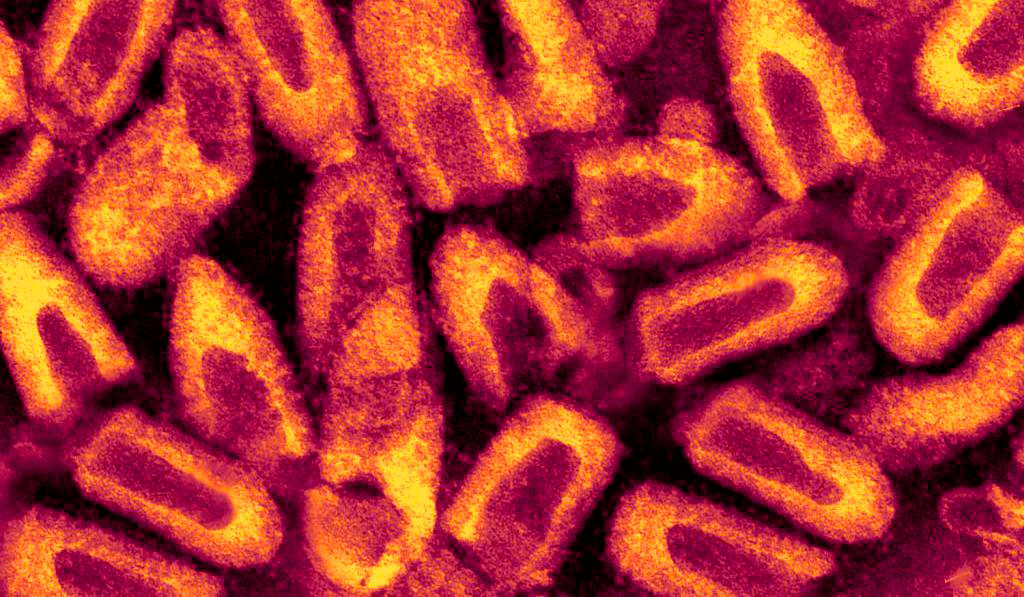
Рисунок 3. Маленькие «пули» опасного вируса бешенства видны нам с помощью сканирующего микроскопа
Смертоносная пуля длиной 180 нм и шириной 75–80 нм [6] имеет двухслойную липидную оболочку, которая довольно сильно по строению напоминает привычную нам мембрану клеток. На своей поверхности вирион имеет шипы длиной 10 нм и шириной 3 нм. Упорядоченное расположение шипов на мембране обеспечивает особый гликопротеид, далее мы будет к нему возвращаться еще несколько раз, запомните его, товарищи.
Вирион — полноценная вирусная частица, находящаяся вне клетки-хозяина.
Под прочной оболочкой внутри вируса залегает одна молекула РНК, свернутая в спираль, она мало похожа на привычные нам РНК клеток и вообще не способна к инфицированию. Но она имеет важное значение для жизни хитрого вируса, поскольку несет в себе минус-цепь РНК или, как её еще называют, рибонуклеопротеид (РНП), который послужит матрицей для синтеза вирусной РНК (вРНК) по правилу комплементарности, как только попадет в клетку-хозяина.
«Сердце» вируса, его генетическая информация
РНК вируса бешенства довольно небольшая и содержит всего 5 генов, кодирующих необходимые белки. Чтобы лучше понимать, что необходимо Neuroiyctes rabid для существования, нам вместе с тобой, уважаемый читатель, стоит лучше разобраться в этом вопросе.
Итак, мы знаем, что у цепи РНК есть два конца: 5′ (место присоединения остатка фосфорной кислоты) и 3′ (место присоединения рибозы).
Начиная с 3′ гены вируса бешенства расположены так:
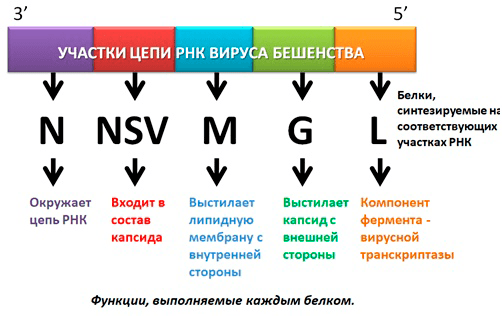
Рисунок 4. Схематичное изображение РНК вируса бешенства, белки, синтезируемые на определенных участках, и их функции
Когда все необходимые белки синтезируются в клетке-хозяине, то белки G и M будут располагаться с двух сторон от оболочки вируса, а N, NSV и L прилегать к минус-цепи РНК (рис. 5).
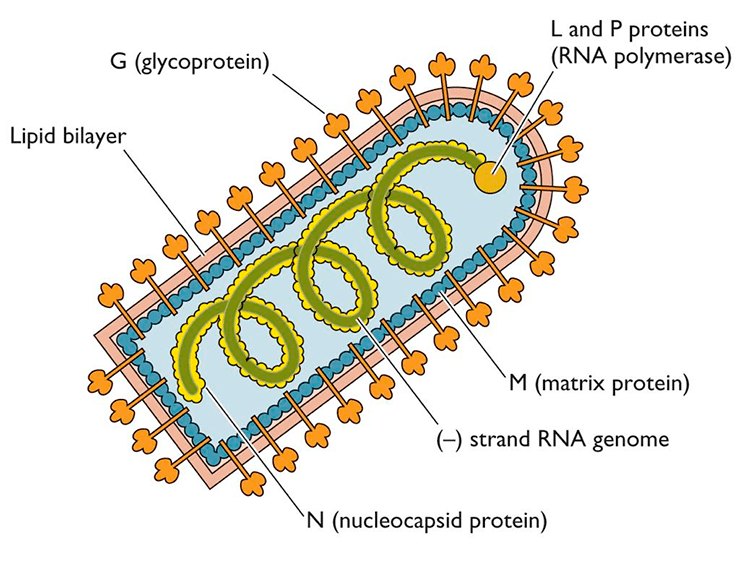
Рисунок 5. Схематичное строение вируса бешенства
Разные рабдовирусы обладают различной степенью устойчивости к неблагоприятным факторам внешней среды. Если говорить о вирусе бешенства, он очень слабенький: неустойчив к воздействию ультрафиолета, высушиванию, нагреванию. При 100 градусах Цельсия вирус может выдержать 2 минуты, а при 60 градусах Цельсия — 5 минут. Это очень мало [7]. Для сравнения: для инактивации возбудителя сибирской язвы необходимо применять автоклавирование при температуре выше 110 градусов Цельсия в течение 40 минут. Вирус бешенства к тому же неустойчив к жирорастворителям, трипсину, а также растворам лизола, хлорамина и фенола [5]. Это значит, что при воздействии на него данных факторов, его защитная оболочка разрушается, а генетическая информация под воздействием ферментов «рассыпается» на нуклеотиды.
Вы правда думаете, что вирус бешенства один?
На самом деле различают несколько диких и один культивированный штаммы вируса бешенства. Первые циркулируют в природе, имеют длительный инкубационный период, чаще образуют специфические тельца, локализуются в нервных клетках, слюнных железах и роговице глаза. К ним относят [7]:
Культивированный (фиксированный) вирус впервые выделил Луи Пастер в 1885 году путем длительного заражения лабораторных кроликов дикой формой вируса, которая мутировала и приобрела определенные, выгодные для нас, качества. Например, она опасна только для лабораторных животных, на которых ее выводили, имеет очень короткий инкубационный период, не образует специфических телец и поражает только ЦНС. Организм человека она не убивает, но заставляет иммунную систему вырабатывать антитела, которые могут защитить и от других, более опасных, штаммов вируса бешенства. Стоит ли говорить, что люди с радостью стали использовать взвесь мозга больных животных в качестве вакцины и успешно практиковали такой метод до сравнительно недавнего времени [5].
Как у вируса появляются дети?
Чтобы создать подобные себе копии, вирусу бешенства, как и любому другому клеточному паразиту, для начала нужно попасть в организм хозяина и найти интересующую его клетку. Мы уже знаем, что излюбленным местом для его размножения является нервная ткань, в особенности — ЦНС. После попадания с зараженной слюной в ткани, шипастый негодяй проводит в мышечной ткани нового хозяина до нескольких дней, затем адсорбируется на нервные окончания с помощью уже известного гликопротеида G и проникает в нервную клетку путем эндоцитоза (рис. 6).
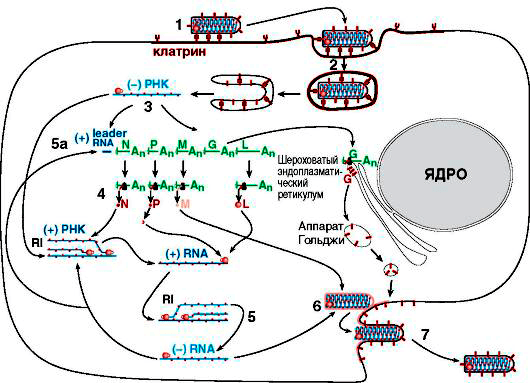
Рисунок 6. Схематичное изображение жизненного цикла вируса бешенства. RNA = РНК.
Дальнейшая скорость протекания жизненного цикла вируса зависит от места попадания в организм: чем дальше от ЦНС, тем дольше вирус будет распространяться по аксонам, ведь скорость его передвижения составляет примерно 3 мм/ч.
Проникнув в клетку, вирус бешенства сливается с мембраной лизосомы, и его внутреннее содержимое высвобождается. Затем в ход идет вирионная транскриптаза, которая обусловливает считывание информации с минус-РНК, и синтез на ней, как на матрице, вРНК. Далее все идет по стандартной схеме биосинтеза белка: к кодонам вРНК по правилу комплементарности пристраиваются антикодоны тРНК, последние перемещаются к рибосомам, где в дальнейшем синтезируются вирусспецифические белки, с которыми мы уже знакомы. вРНК связывается с N, L и NSV в нуклеокапсид, который подходит к назначенному месту, где уже в плазмалемму (клеточную мембрану) клетки-хозяина успешно встроились M и G. Затем генетическая информация и прилежащие белки обволакиваются мембраной, и путем эндоцитоза в области дендритов (отростков нервных клеток) выходят новые вирионы.
Вирус бешенства, по сравнению со многими другими рабдовирусами, довольно медленно «размножается» в клетках хозяина, этот процесс может занимать несколько суток. Для примера, вирусу везикулярного стоматита для этих целей требуется несколько часов. Предполагается, что скорость размножения различных вирусов зависит от уровня активности вирионной транскриптазы [8].
Кроме того, вирус бешенства может блокировать биосинтез нормальных белков клетки [5] и повышать экспрессию и выделение цитокинов (клеточных медиаторов) в близлежащих, незараженных клетках, что, вероятно, способствует развитию энцефалита [9].
Когда меры предосторожности не сработали
«Хьюстон, у нас проблемы!»
Я искренне надеюсь, что вам никогда в жизни не понадобится несколько следующих абзацев, но с моей стороны было бы преступно упустить это.
Итак, если вас все же покусал или облизал зверь (рис. 6), лучше не надеяться на лучшее, а экстренно применять необходимые меры. Для начала хорошенько промойте место укуса водой с мылом, а затем прижгите спиртовым раствором йода. Если вы вдруг врач-эпидемиолог, спешащий на работу, или обычный смертный, в руках у которого почему-то есть антирабический иммуноглобулин, то это как раз то время, когда стоит его применить по назначению. Сходить к врачу все равно придется, но шансы на выживание у вас резко возрастут.
Если вы хотите, чтобы больше никто не пострадал (а я уверена, что хотите), то вызовите бравую бригаду СББЖ (станции по борьбе с болезнями животных), они усыпят животное и доставят его в лабораторию целиком или только голову, иногда могут достать головной мозг и законсервировать его 50-процентным глицерином, если поездка обещает быть достаточно долгой. Трупный материал упаковывают в плотный полиэтиленовый мешок, а мозг в банку с пробкой, которую к тому же заливают парафином, а потом все это дополнительно помещают в водонепроницаемую тару, чтобы полностью себя обезопасить.
На СББЖ материал с подозрением на бешенство без очереди и всякого промедления исследуют смелые ветеринары, ведь в данном случае речь может идти о сохранении жизни укушенного человека. Работая с, вероятно, зараженным мозгом, надевают две пары перчаток, защитные очки на глаза и шесть марлевых повязок, прикрывающих нос и рот, все манипуляции проводят в стерильных условиях [10]. Представляете, как все серьезно?
Сколько времени в запасе?
Скорость течения болезни может сильно варьировать: инкубационный период длится от 10 до 90 дней и более, но обычно около месяца. Быстрее всего он проходит при попадании вируса в области лица и головы, причем для этого не обязательно, чтобы вас за щечки покусала собака с пеной у рта, ведь проникновение вируса в организм возможно не только через повреждение кожных покровов, но и через слизистые оболочки.
Как только вирус попал в рану или на слизистую, он не спешит оттуда уходить и только через 1–4 дня проникает в нервную ткань. Конечно, ему не терпится скорее попасть в ЦНС и вызвать смертельный энцефалит, но ведь тело хозяина имеет еще парочку пригодных мест, интересующих вирус бешенства, а именно: слюнные железы и роговица глаза. Проникновение в первые из перечисленных имеет принципиальное значение для передачи вируса новым хозяевам.
Не придал значения и умер
В развитии заболевания выделяют три стадии: начальную (она идет сразу после инкубационного периода), возбуждения и параличей [11], [12]. В любом случае, не советую вам ждать ни одну из них. Когда появятся симптомы, будет уже слишком поздно, ведь излечение возможно только во время инкубационного периода. Впрочем, существует гипотеза, согласно которой бешенство можно вылечить путем ингибирования пептидов вируса непосредственно в зараженном организме [13], так что, вероятно, через несколько лет данная проблема будет решена, но пока что будем читать и бояться.
1. Начальная стадия.
Появляются беспокойство и страх, тошнота, головокружение, зуд и покраснение в области укуса. Длится от 1 до 3 дней.
2. Стадия возбуждения.
Возбуждение, судороги гортани и глотки, водобоязнь, агрессивность, галлюцинации. Именно в этот период появляются наиболее привычные симптомы бешенства. Из-за невозможности глотать слюну, она взбивается в пену и валит изо рта. Есть даже предположение, что водобоязнь провоцирует животное разбрасывать слюну, так как даже вид жидкости вызывает болезненные спазмы глотки. Домашние животные, которые обычно не отходят от дома дальше, чем на один километр, беспокойно бегают, превращаются в бродяг и стремятся напасть на все, что движется (или даже не движется), что, конечно, способствует распространению заболевания. Дикие животные теряют страх перед человеческими поселениями и выходят из леса, чаще всего, кусая домашних животных, реже — человека. Иногда может наблюдаться, наоборот, излишняя ласковость зараженных животных, их стремление поскорее облизать вас, что на самом деле еще более опасно, так как вызывает меньше подозрений.
Также существует исследование, которое дает нам объяснение подобных изменений в поведении. Дело в том, что гликопротеид G, содержащийся на поверхности вируса бешенства, умеет «выключать» никотиновые ацетилхолиновые рецепторы, находящиеся в центральной нервной системе. Ацетилхолин в норме передает сигнал от мозга к мышцам, заставляя их расслабляться. Из-за того, что при бешенстве он перестает восприниматься специальными рецепторами, уровень двигательной активности зараженных организмов повышается [13].
3. Стадия параличей.
Через 5–7 дней после начала появления симптомов смерть наступает от паралича дыхательной или сердечной мускулатуры, так как нервная система перестает посылать им сигналы о необходимых сокращениях.
Когда очень хочется жить. Лечение
Так как бешенство особо опасное заболевание, его лечение представляет собой скорее попытку вызвать искусственный активный иммунитет у предполагаемых больных. Удивительно, что пастеровские методы вакцинации применялись вплоть до XX века, а в сознании граждан навсегда закрепилась фраза «не гладь кошечку, а то будут ставить 40 уколов в живот». Такое количество инъекций обусловлено использованием взвеси мозга зараженных овец, так называемой вакцины Ферми.
Современные же вакцины имеют ряд неоспоримых преимуществ [14]:
Сплошные плюсы! Более того, в настоящее время используют препарат, состоящий не из цельных вирусных частиц, а из гликопротеина вируса бешенства (того самого G), который обладает высокой иммуногенностью. В этом случае количество необходимых инъекций снижается до шести, а в некоторых случаях даже до трех. Активный иммунитет к бешенству достигается последовательностью инъекций ослабленного вируса и может не снижаться от одного года до трех лет [3].
Если вирус попал в область головы и шеи, то, как я уже говорила, он развивается очень быстро, поэтому людям вводят готовый специфический иммуноглобулин, который создает пассивный иммунитет, что несколько продлевает инкубационный период и несколько отдаляет момент гибели зараженного. Антирабический иммуноглобулин получают из 10-процентной сыворотки крови зараженных бешенством лошадей [15].
Просто о сложном. Лабораторная диагностика
А что если не бешенство?
Конечно, у каждого укушенного и облизанного возникают мысли: «Этот котик был точно привит, никакого бешенства и быть не может». Так что я хочу рассказать о том, как ставят диагноз и почему в нем не надо сомневаться.
В лаборатории СББЖ проводится четырехступенчатый анализ материалов, которые были добыты от того животного, которое на вас напало. Принято придерживаться данной последовательности методов лабораторной диагностики:
1. Гистологический метод для обнаружения телец Бабеша—Негри.
В зараженных клетках можно обнаружить специфические включения, так называемые тельца Бабеша—Негри, которые могут быть размером до 25 мкм, а значит, они хорошо видны в световой микроскоп. Их точная функция до сих пор не ясна.
Из головного мозга животного с левой и правой сторон берут материал на гистологические срезы или мазки. Вирус бешенства локализуется в определенных частях головного мозга, таких как Аммонов рог (гиппокамп), мозжечок, кора полушарий и продолговатый мозг (рис. 7). Суммарно получается восемь гистопрепаратов. Мазки или срезы подвергаются окраске по Селлерсу (тельца получаются розово-красного цвета (рис. 8)) или Муромцеву (окраска телец фиолетовая с темно-синими включениями (рис. 9)).
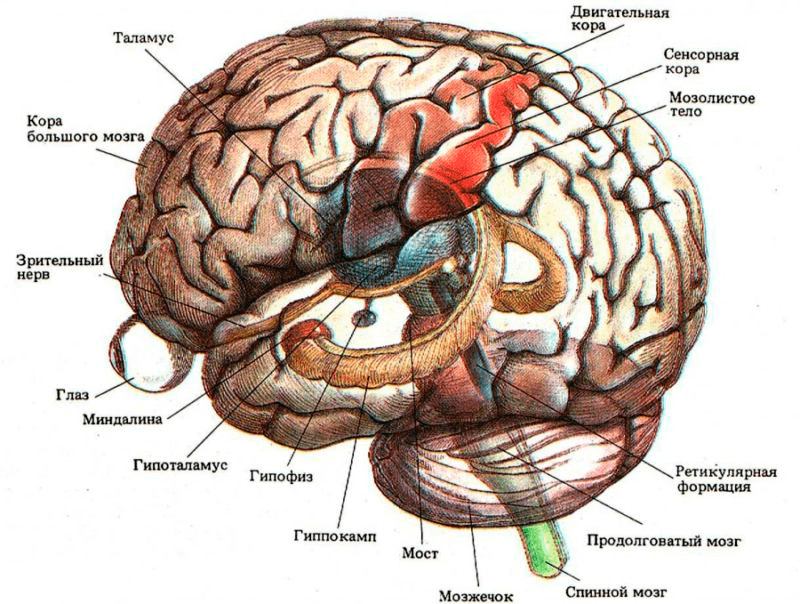
Рисунок 7. Места локализации телец Бабеша—Негри в головном мозге: гиппокамп, продолговатый мозг, мозжечок, кора полушарий
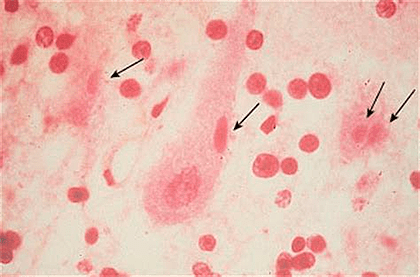
Рисунок 8. Тельца Бабеша—Негри насыщенного розового цвета, окраска по Селлерсу
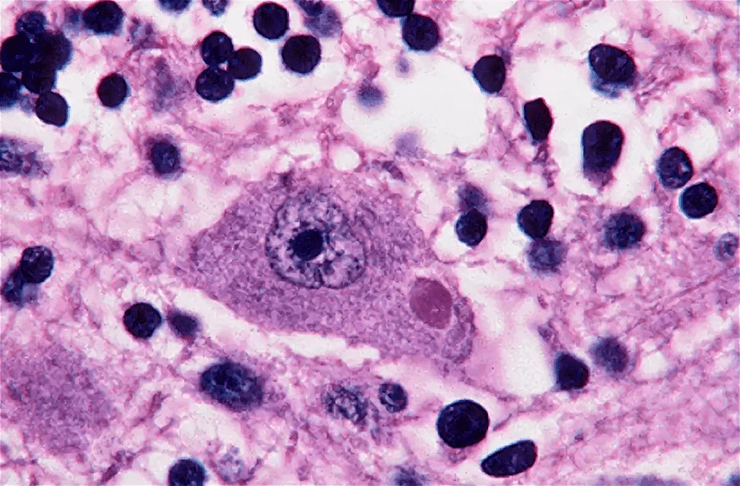
Рисунок 9. Тельца Бабеша—Негри темно-фиолетового цвета, окраска по Муромцеву
Обнаружение телец Бабеша—Негри является бесспорным доказательством заражения животного бешенством, однако у некоторых здоровых животных, например, кошек или собак, умерших в результате укуса ядовитой змеи или электрического тока, в головном мозге могут присутствовать включения, похожие на искомые тельца. Кроме того, тельца Бабеша—Негри обнаруживаются у больных животных только в 65–85%. Так что, если их нет, материал обязательно проверяют в дополнительных тестах.
2. Реакция иммунофлюоресценции (РИФ).
Незаменимый и очень точный метод (в 99% случаев результаты совпадают с результатами биопробы). Для него используют те же мазки или срезы, что и для гистологии.
Этот и следующий методы основаны на том, что антитело всегда находит свой антиген. Так как мы знаем антитела (иммуноглобулины) против вируса бешенства, то можем использовать их для обнаружения его антигенов.
Антирабический флюоресцирующий иммуноглобулин вводят в пробу, фиксируют препарат ацетоном, охлажденным до 10 градусов Цельсия, не менее четырех часов. Затем через люминесцентный микроскоп оценивают интенсивность свечения комплекса антиген—антитело, который выглядит как зеленые или желто-зеленые гранулы и часто находится вне клеток (рис. 10) [16].
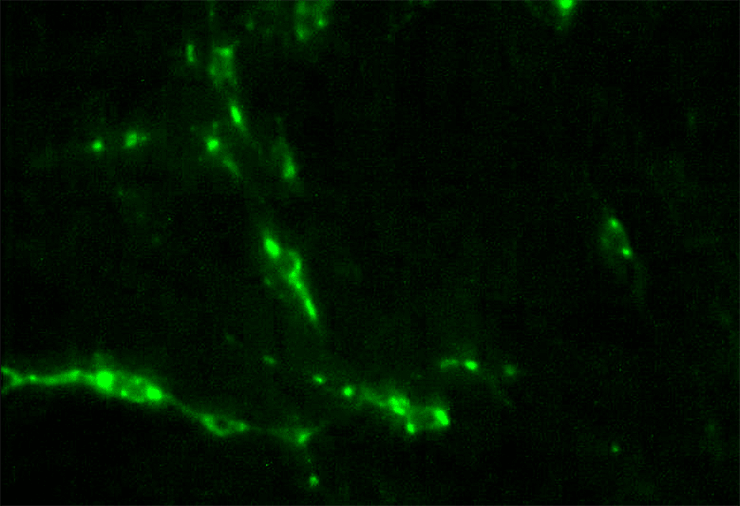
Рисунок 10. РИФ-положительная окраска FITC-меченными моноклональными антителами, увеличение 100×
Данный метод дает возможность исследовать не только мозг, но и другие органы животного, а именно роговицу и слюнные железы, что может помочь при постановке диагноза.
3. Реакция диффузной преципитации в геле (РДП).
Этот метод применяют при работе с неконсервированным материалом. Он основан на диффузии антигенов и антител в 1–1,5-процентном агарозном геле. В этом геле специально создаются лунки, куда помещают измельченные части мозга, подверженные заражению, и специфические иммуноглобулины. При наличии 1–3 линий преципитации (соединения) между лунками с антигеном и иммуноглобулином тест считается положительным, а животное больным бешенством с вероятностью 45–70%.
Даже если телец Бабеша–Негри не найдено, а РИФ и РДП показали отрицательный результат, все еще нельзя точно сказать, что животное не больно. На помощь приходит метод биопробы, так как он считается наиболее эффективным.
Итак, лабораторным животным (чаще мышам-сосункам или сирийским хомякам) прямо в мозг вводят ткань предполагаемого зараженного животного. И хоть результатов нужно ждать не менее четырех дней, метод поражает своей простотой и эффективностью: появились симптомы — материал был получен от больного животного, нет — скорее всего, оно было здорово.
Но есть два «но», которые носят названия «лисицы» и «скунсы». В мозге особей этих видов, павших от бешенства, обнаружено вещество, которое ингибирует инфекционность вируса. Биопроба с таким материалом будет отрицательна вне зависимости от того, заражено животное или нет.
Есть и другие лабораторные методы выявления бешенства, но они либо трудновыполнимы, либо еще не вошли в постоянное использование из-за низкой эффективности [10], [17].
Профилактика бешенства вчера и сегодня
Вы что, хотите убивать лисичек?
Итак, бешенство — опасно, оно может убить небольшой город и это во времена, когда уже существует доступная и действенная вакцина. Что мы делаем не так?
Для начала нужно понять, как избежать распространения вируса. Самое основное — ликвидация городских и диких очагов. По данным ВОЗ, 99% заражений бешенством происходит именно от укусов домашних или уличных городских животных. Многие страны проводят успешные иммунизацию и учет бродячих животных, что блокирует передачу вируса. В России же наблюдается повсеместное увеличение их числа, из-за чего 420–470 тыс. человек обращается с укусами в поликлиники ежегодно [18]!
Однако не стоит забывать, что дикие бешеные животные теряют осторожность и подходят вплотную к поселениям, а значит, тоже представляют опасность для человека. В нашем регионе основным переносчиком являются лисицы [19].
Наверняка вы помните о таком явлении, как популяционные волны — колебания численности живых организмов. Так вот, чем выше численность популяции диких животных, тем больше вероятность вспышек бешенства среди них, а отстрел дает лишь временный и весьма сомнительный результат. Что делать? Ряд стран уже применяет методику скармливании оральных антирабических вакцин диким животным. Успешные опыты проводят в США с 1976 года [20]. Достаточно раз в год размещать приманку с вакциной в местах обитания диких зверей, чтобы они её съели и не болели бешенством. И лисы живы, и люди целы. Однако такую программу лучше не начинать, если она планируется на срок менее чем шесть лет, не будет крупномасштабной или спланированной [21].
Также не стоит забывать и о сельскохозяйственных животных — они зачастую становятся жертвами бешенных некрупных плотоядных, таких как кошки, летучие мыши и многие другие. Вспышки бешенства на агропромышленных предприятиях очень тяжело остановить, так что профилактика бешенства должна носить регулярный, а не экстренный характер [22].
Кроме того, существуют рекомендации по доконтактной вакцинации людей, проживающих в местах с частыми эпизоотиями бешенства [3].
О будущем
В наше время идет настоящая борьба за то, чтобы бешенство стало отголоском прошлого и больше не несло за собой столько потерь. ВОЗ, Всемирная организация здравоохранения животных (МБЭ), Продовольственная и сельскохозяйственная организация ООН (ФАО) и Глобальный альянс по борьбе против бешенства (ГАББ) учредили партнерство «Объединенные против бешенства» (United against rabies), целью которого является полностью устранить случаи заражения этим заболеванием к 2030 году. United against rabies выдвигает два основных направления работы: информирование населения, регулярная и доступная вакцинация людей и животных [4]. Вероятно, даже мы с вами застанем момент, когда бешенство будет полностью искоренено.
Изложение личных надежд
Не так давно человечество отошло от пастеровских методов вакцинации против бешенства. Мы стремимся на Марс, но не можем спастись от чего-то столь небольшого, как вирусы, а пули длиной 180 нм уносят больше жизней, чем боевые снаряды. Иронично, не правда ли? Однако я всей душой верю, что даже просвещение аудитории посредством сведения ключевых моментов в небольшую статью, может сыграть решающую роль в спасении чьей-то жизни. Надеюсь, в скором времени положение людей в борьбе с вирусами на арене жизни изменится в нашу пользу, а пока что ждем, надеемся и не трогаем диких животных.
Источники:
